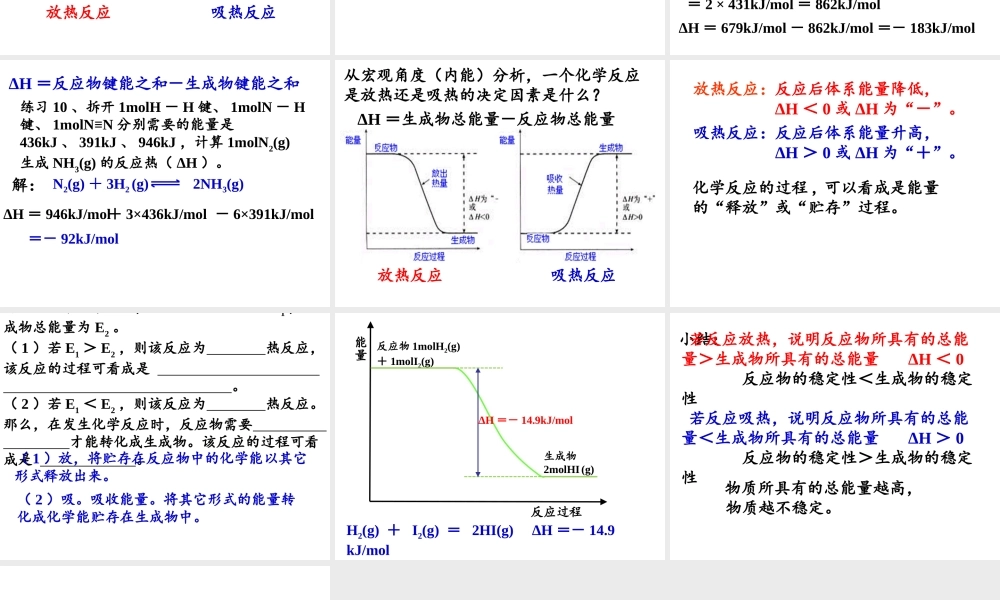
第一节 化学反应与能量的变化 第一章 化学反应与能量(第一课时) 学习目标:1 、了解化学反应中能量转化的原因和常见的能量转化形式。2 、认识化学反应过程中同时存在着物质和能量的变化,而且能量的释放或吸收是以发生变化的物质为基础的,能量的多少取决于反应物和生成物的质量。3 、了解反应热和焓变的涵义。学习重点、难点:重点:化学反应中的能量变化。难点:焓变, ΔH 的“+”与“-”。一个化学反应的过程,本质上就是 旧化学键断裂和新化学键形成的过程。吸收能量放出能量一、焓变、反应热焓 (H) :与内能有关的物理量。焓变 (ΔH) :生成物与反应物的焓值差 ΔH = H( 生成物 ) - H( 反应物 )一般反应都是在敞口容器中进行的,反应系统的压力与外界压力相等。在恒压条件下进行的反应,反应的热效应等于焓变。用 ΔH 表示反应热单位: kJ/mol 或 kJ·mol - 1能量反应过程生成物反应物反应热E1E2自由原子、自由离子能量反应过程生成物反应物反应热E1E2自由原子、自由离子放热反应吸热反应从微观角度(化学键)分析,化学反应过程中为什么会有能量的变化?一个化学反应的过程,本质上就是 旧化学键断裂和新化学键形成的过程。吸收能量放出能量而一般化学反应中,旧键的断裂所吸收的总能量与新键形成所放出的总能量是不相等的,而这个差值就是反应中能量的变化。所以化学反应过程中都会有能量的变化。生成物分子形成时释放的总能量= 2 × 431kJ/mol = 862kJ/mol反应物分子断裂时吸收的总能量= 436kJ/mol + 243kJ/mol = 679kJ/molΔH = 679kJ/mol - 862kJ/mol =- 183kJ/molΔH =反应物键能之和-生成物键能之和练习 10 、拆开 1molH - H 键、 1molN - H键、 1molN≡N 分别需要的能量是436kJ 、 391kJ 、 946kJ ,计算 1molN2(g)生成 NH3(g) 的反应热( ΔH )。ΔH = 946kJ/mol解: N2(g) + 3H2 (g) 2NH3(g)+ 3×436kJ/mol - 6×391kJ/mol=- 92kJ/molΔH =生成物总能量-反应物总能量从宏观角度(内能)分析,一个化学反应是放热还是吸热的决定因素是什么?放热反应吸热反应放热反应:吸热反应:反应后体系能量降低,ΔH < 0 或 ΔH 为“-”。反应后体系能量升高,ΔH > 0 或 ΔH 为“+”。化学反应的过程 , 可以看成是能量的“释放”或“贮存”过程。练习 9 、某化学反应,设反应物总能量为 E1 ,生成物总能...