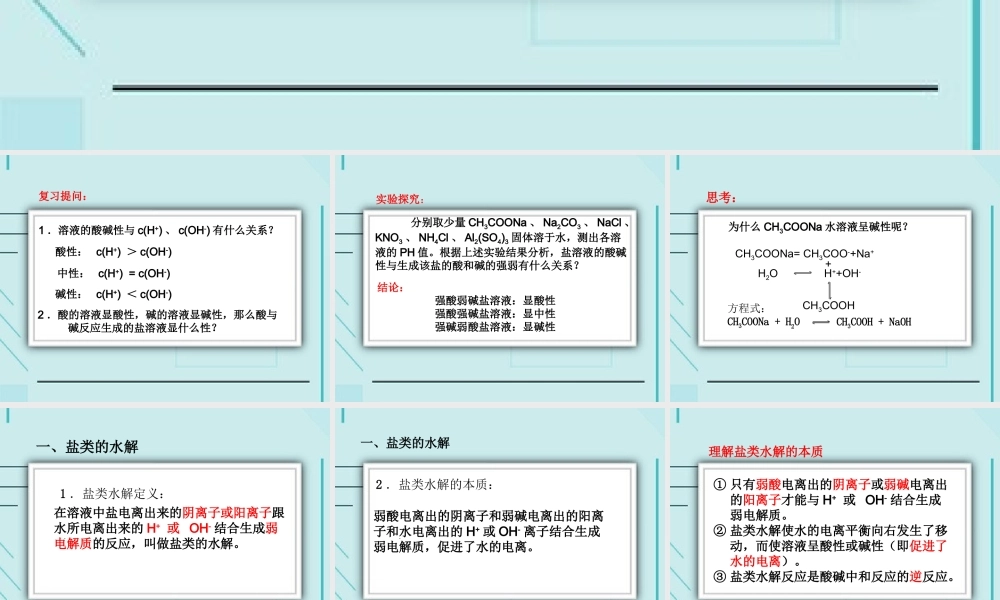
第三节 盐类的水解第一课时 盐类的水解枣阳市白水高中 高锦元复习提问:2 .酸的溶液显酸性,碱的溶液显碱性,那么酸与 碱反应生成的盐溶液显什么性?1 .溶液的酸碱性与 c(H+) 、 c(OH-) 有什么关系?酸性: c(H+) > c(OH-)中性: c(H+) = c(OH-)碱性: c(H+) < c(OH-)实验探究: 分别取少量 CH3COONa 、 Na2CO3 、 NaCl 、KNO3 、 NH4Cl 、 Al2(SO4)3 固体溶于水,测出各溶液的 PH 值。根据上述实验结果分析,盐溶液的酸碱性与生成该盐的酸和碱的强弱有什么关系?结论: 强酸弱碱盐溶液:显酸性 强酸强碱盐溶液:显中性 强碱弱酸盐溶液:显碱性为什么 CH3COONa 水溶液呈碱性呢? CH3COOH + NaOH 方程式:CH3COONa + H2O CH3COONa= CH3COO-+Na+H2O H++OH- CH3COOH +思考:1 .盐类水解定义:一、盐类的水解在溶液中盐电离出来的阴离子或阳离子跟水所电离出来的 H+ 或 OH- 结合生成弱电解质的反应,叫做盐类的水解。2 .盐类水解的本质:一、盐类的水解弱酸电离出的阴离子和弱碱电离出的阳离子和水电离出的 H+ 或 OH- 离子结合生成弱电解质,促进了水的电离。① 只有弱酸电离出的阴离子或弱碱电离出的阳离子才能与 H+ 或 OH- 结合生成弱电解质。② 盐类水解使水的电离平衡向右发生了移动,而使溶液呈酸性或碱性(即促进了水的电离)。③ 盐类水解反应是酸碱中和反应的逆反应。理解盐类水解的本质一、盐类的水解3 .盐类水解方程式书写( 1 )盐类水解是可逆反应,写方程式要用“ ”。( 2 )一般盐类水解程度很小,生成的弱酸或弱碱浓度很小,通常书写时产物不用“↑”和“↓”。( 3 )多元弱酸生成的盐水解时,生成弱酸过程应分步表示,以第一步为主。弱碱阳离子水解一步完成。( 4 )盐类发生双水解水解程度很大时,通常生成气体或沉淀,书写时产物用“ =” 、“↑”和“↓”,如铝离子与碳酸根双水解生成氢氧化铝沉淀与二氧化碳气体。写出 NaClO 、 Na2CO3 、 Na3PO4 、 NH4Cl Al2(SO4)3 水解的化学方程式和离子方程式。课堂练习:二、盐类水解的类型和规律1 .类型2 .规律有弱才水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性。( 1 )强碱弱酸盐( 2 )强酸弱碱盐( 3 )弱酸弱碱盐1 .下列各物质投入水中,因促进水的电离而使溶液呈酸性的是( )。A . NaHSO4 B . Na3PO4 C . CH3COOH D . Al2(SO...