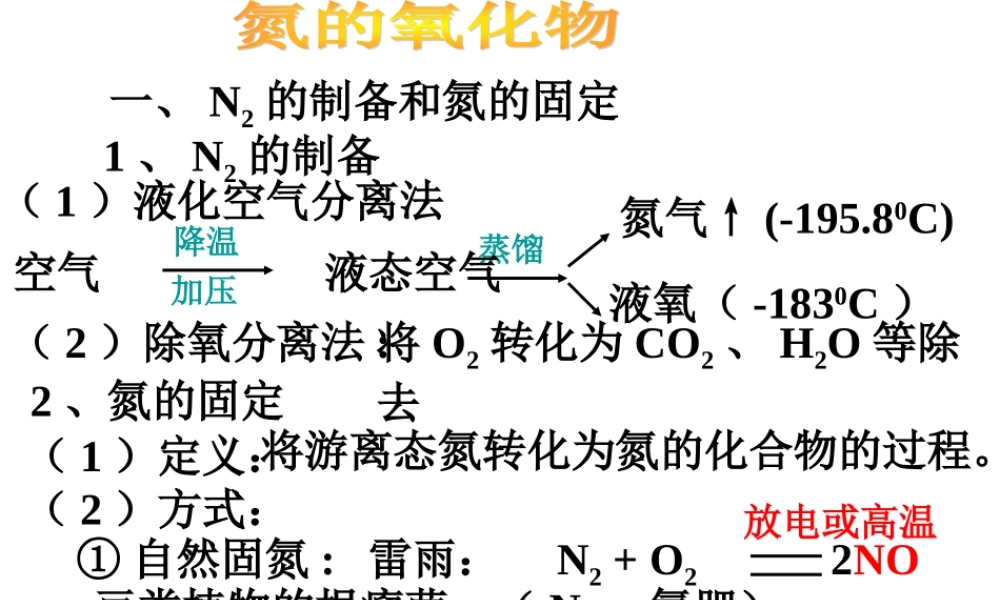
一、 N2 的制备和氮的固定1 、 N2 的制备( 1 )液化空气分离法( 2 )除氧分离法 :将 O2 转化为 CO2 、 H2O 等除去降温加压蒸馏氮气↑ (-195.80C)液氧( -1830C )空气 液态空气2 、氮的固定( 1 )定义:( 2 )方式:将游离态氮转化为氮的化合物的过程。① 自然固氮 :豆类植物的根瘤菌:( N2→ 氮肥)N2 + O2 2NO放电或高温雷雨:② 人工固氮:N2 + 3H2 2NH3 高温高压催化剂工业合成氨 二、氮的几种重要氧化物+1+2+3+4+4+5氧化物N2ONON2O3NO2N2O4N2O5注意:( 1 )氮的氧化物都有毒,除 NO2 外其余无色。( 2 ) N2O 俗名“笑气”, N2O3 为亚硝酸酐, N2O5 为硝酸酐。( 3 ) +4 价有两种,常温下 :2NO2 (红棕色) N2O4 (无色) ; 所以没有纯净的 NO2 或 N2O4 。( 4 ) NO 、 NO2 是大气污染物,主要来源于 石油和煤的燃烧、汽车尾气、硝酸厂废气, 可引起光化学烟雾和酸雨。( 5 ) NO 、 NO2 性质的对比 NO : 色 的气体, 溶于水 2NO+O2=2NO2 (红棕色) (NO 检验方法 ) 故: NO 与 O2 不能共存,收集 NO 只能用排水法不能用排空气法。 无有毒不NO 的收集方法? NO2: 色, , 的气体, 溶于水,跟水反应。易液化。( NO2 不能用排水法收集,只能用排空气法。)3NO2 + H2O = 2HNO3 + NO (工业制硝酸)[ 科学探究 ] P92红棕有刺激性 有毒易 3NO2 + H2O = 2HNO3 + NO 2NO + O2 = 2NO2 2 、 NO 和 NO2 的性质NONO2物理性质化学性质无色,不溶于水红棕色,有刺激性气味的有毒气体,易溶于水,易液化 现给你一试管二氧化氮,其它药品仪器自选。1. 设计实验,要求尽可能多的使二氧化氮被水吸收。2. 你的设计对工业生产硝酸有什么启示? ( 从原料的充分利用、减少污染物的排放等方面考虑 ) 实验步骤现象解释123将一支充满 NO2 的试管倒立在盛有水的水槽中制取少量氧气将氧气缓慢通入步骤 1的试管中红棕色气体逐渐消失 , 水位上升 , 最后水充满整个试管的 2/3,无色气体充满试管的 1/3( 上部 )无色气体变为红棕色气体 ,但气体体积逐渐缩小 , 液面不断上升3NO2+H2O==2HNO3+NONO2 为红棕色气体 , 易溶于水 ,NO 为无色气体 ,难溶于水 .2NO+O2=2NO23NO2+H2O==2HNO3+NO2H2O2====2H2O+O2↑MnO22KClO3====2KCl+3O2↑MnO2△ 在这个过程中要通入多少 O2 , NO2 才能完全转变成...