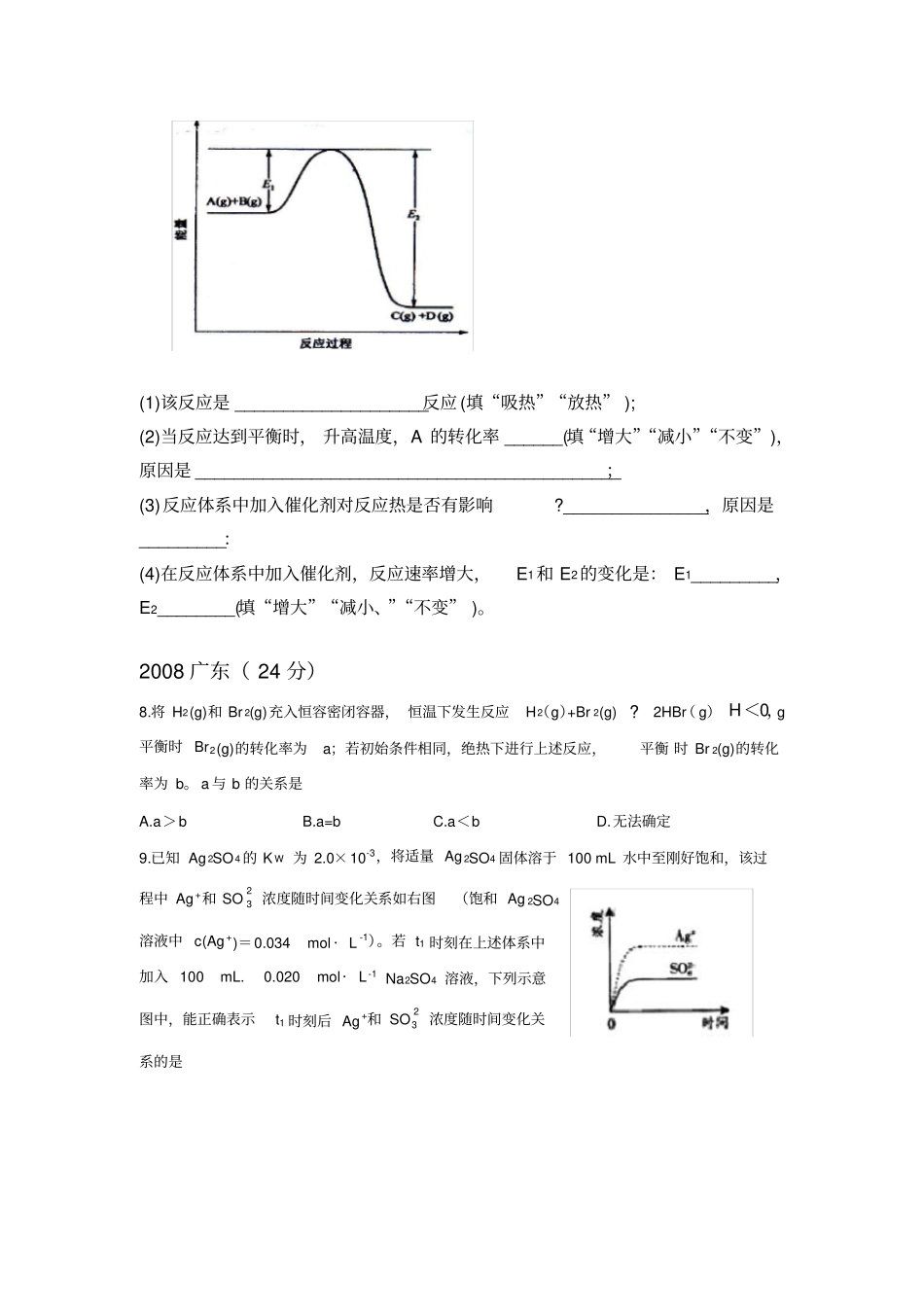
化学反应原理的高考试题2008 山东( 20 分)14.高温下, 某反应达平衡, 平衡常数K=c(CO) ·c(H2O)c(CO 2) ·c(H2) 。恒容时, 温度升高, H 2 浓度减小。下列说法正确的是A.该反应的焓变为正值B.恒沮恒容下,增大压强,H 2浓度一定减小C.升高温度,逆反应速率减小D.该反应化学方程式为CO + H2催化剂高温CO2 + H215. 某温度时, BaSO4 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是提示 BaSO4(s) Ba2+(aq)+SO42-(aq)的平衡常数 Ksp=c(Ba 2+ ) ·c(SO42-),称为 溶度积常数 。A.加人 Na2SO4 可以使溶液由a 点变到 b 点B. 通过蒸发可以使溶液由d 点变到 c 点C.d 点无 BaSO4 沉淀生成D.a 点对应的 Ksp 大于 c 点对应的 Ksp29.(12 分)北京奥运会"祥云火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H 6)。(l)丙烷脱氢可得丙烯。已知: C3H 8(g) =CH 4(g)+HC≡CH(g) + H2(g)△ H 1=156.6KJ ·mol-1CH 3CH=CH 2(g)=CH 4(g)+HC ≡CH(g) △H2=32.4KJ ·mol-1则相同条件下,反应C3H8(g)=CH 3CH=CH 2(g)+ H 2(g)的△ H= KJ·mol- 1(2)以丙烷为燃料制作新型燃料电池,电池的正极通人O2 和 CO 2,负极通人丙烷.电解质是熔融碳酸盐。电池反应方程式为;放电时, CO32-移向电池的(填“正”,或“负”)极。(3)碳氢化合物完全燃烧生成CO 2 和 H2O。常温常压下,空气中的CO2,溶于水达到平衡时,溶液的pH=5.6 ,c(H 2CO 3)=l.5 ×10-5mol ·L -1。若忽略水的电离及H 2CO 3 的第二级电离,则H 2CO 3HCO 3-的平衡常数K 1= 。(已知:10-5.60=2.5×10-6) (4)常温下, 0.lmol · L-1NaHCO 3 溶液的 pH 大于 8,则溶液中 c(H 2CO 3) c(CO 32-)(填“ >”、“=”或“<” ),原因是(用离子方程式和必要的文字说明)。2008 宁夏( 20 分)13.已知 H2(g) 、C2H4(g) 和 C2H5OH(1) 的燃烧热分别是-285.8kJ·mlo-1、-1411.0kJ· mlo-1 和-1366.8kJ,则由 C2H4(g) 和 H2O(I) 反应生成 C2H5OH(I) 的△H 为A.-44.2kJ ·mol-1B.+44.2kJ·mlo-1C.-330kJ · mol -1D.+330kJ· mlo -125.(14 分)已知可逆反应:请回答下列问题:( 1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol,L-1, c(N)=2.4 mol · L-1; 达到平衡后, M 的转化率为60%,此时 N 的转化率...