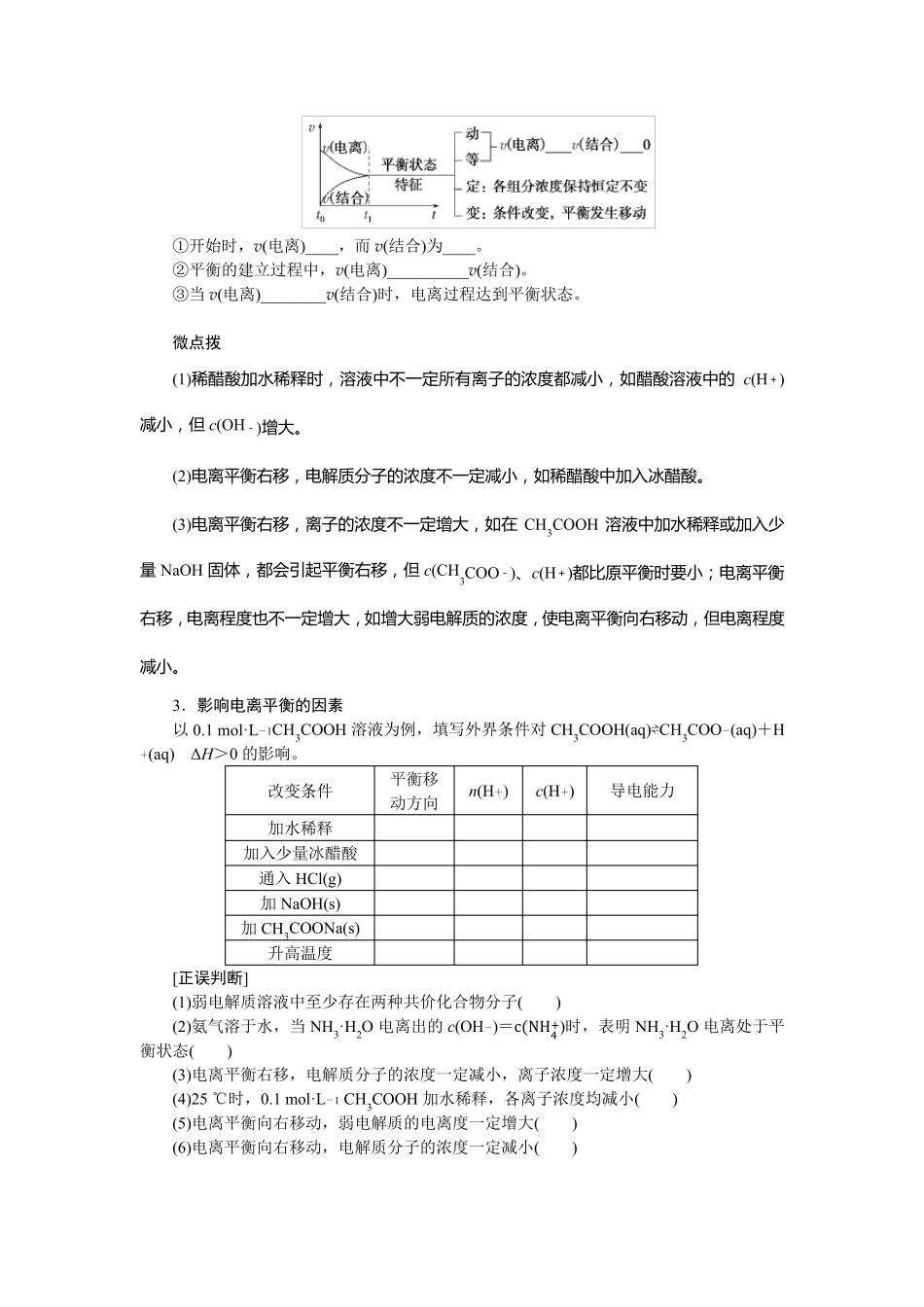
第25 讲 电离平衡� 复 习 目 标 1.了 解 电 解 质 的 概 念 , 了 解 强 电 解 质 和 弱 电 解 质 的 概 念 。 2.理 解 电 解 质 在 水 中 的 电 离 以 及 电 解 质 溶 液 的 导 电 性 。 3.理 解 弱 电 解 质 在 水 中 的 电 离 平 衡 , 能 利 用 电 离 平 衡 常 数 进 行 相 关 计 算 。 考点一 弱电解质的电离平衡 必备知识整理 1.强、弱电解质 (1)定义与物质类别 (2)电离方程式的书写——“强等号,弱可逆,多元弱酸分步离” ①强电解质,如H2SO4:__________________________________________________。 ②弱电解质 a.一元弱酸,如CH3COOH:_______________________________________________。 b.多元弱酸,分步电离,分步书写且第一步的电离程度远大于第二步的电离程度,如H2CO3:_________________________________________________________。 c.多元弱碱,分步电离,一步书写,如Fe(OH)3: ________________________________________________________________________。 ③酸式盐 a.强酸的酸式盐,如NaHSO4 在水溶液中: ____________________________________________________________。 熔融时:_____________________________________________________。 b.弱酸的酸式盐:“强中有弱”,如NaHCO3: ________________________________________________________________________ ________________________________________________________________________。 2.弱电解质的电离平衡 (1)电离平衡的建立 在一定温度下,当弱电解质____________的速率和________的速率相等时,电离过程达到了平衡。 (2)电离平衡的建立与特征 ①开始时,v(电离)____,而v(结合)为____。 ②平衡的建立过程中,v(电离)__________v(结合)。 ③当v(电离)________v(结合)时,电离过程达到平衡状态。 微点拨 (1)稀 醋 酸 加 水 稀 释 时 , 溶 液 中 不 一 定 所 有 离 子 的 浓 度 都 减 小 , 如 醋 酸 溶 液 中 的c(H+ )减 小 , 但 c(OH- )增 大 。 (2)电 离 平 衡 右 移 , 电 解 质 分 子 的 浓 度 不 一 定 减 小 , 如 稀 醋 酸 中 加 入 冰 醋 酸 。 (3)电 离 平 衡 右 移 , 离 子 的 浓 度 不 一 定 增 大 , 如 在CH3COOH...