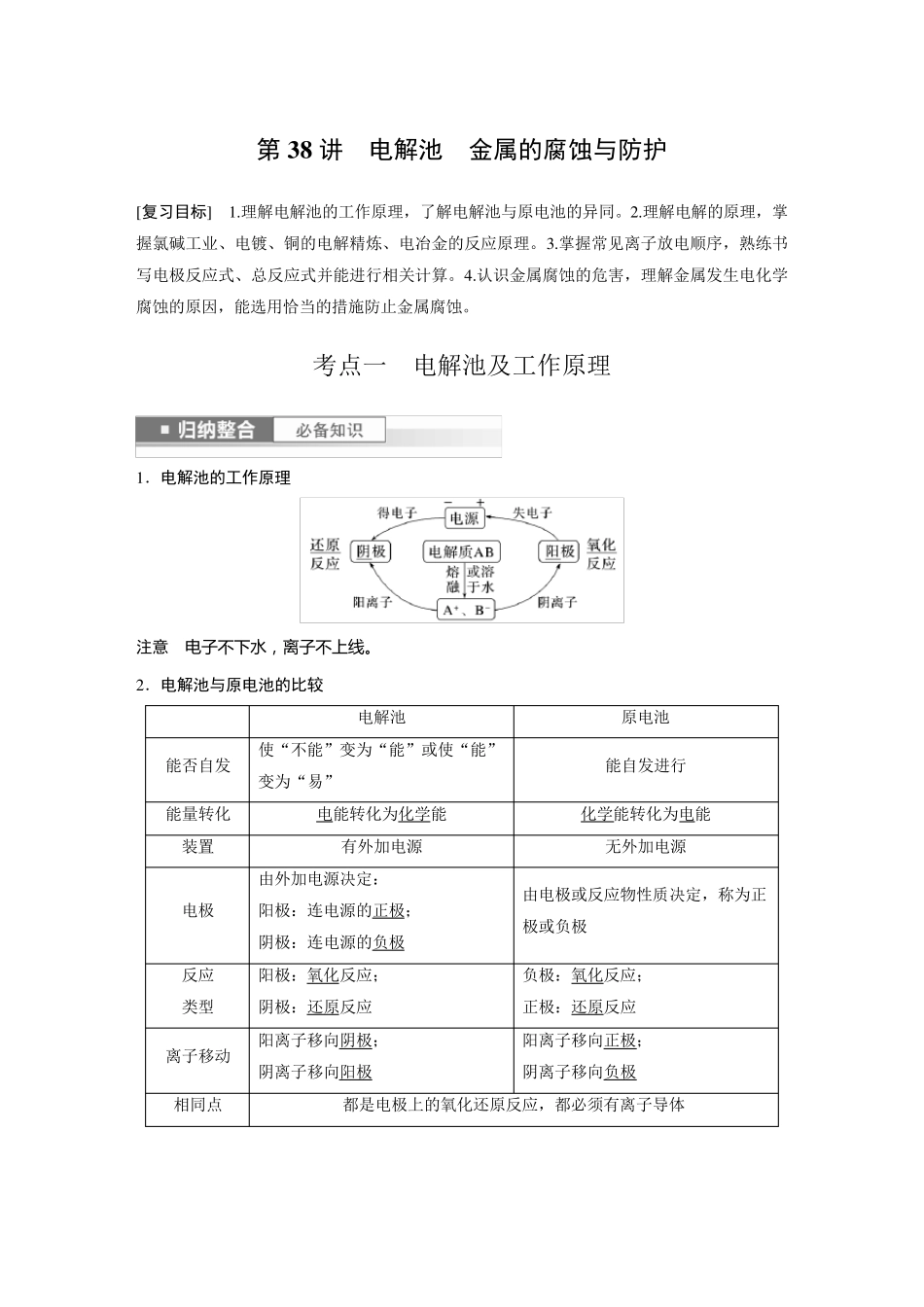
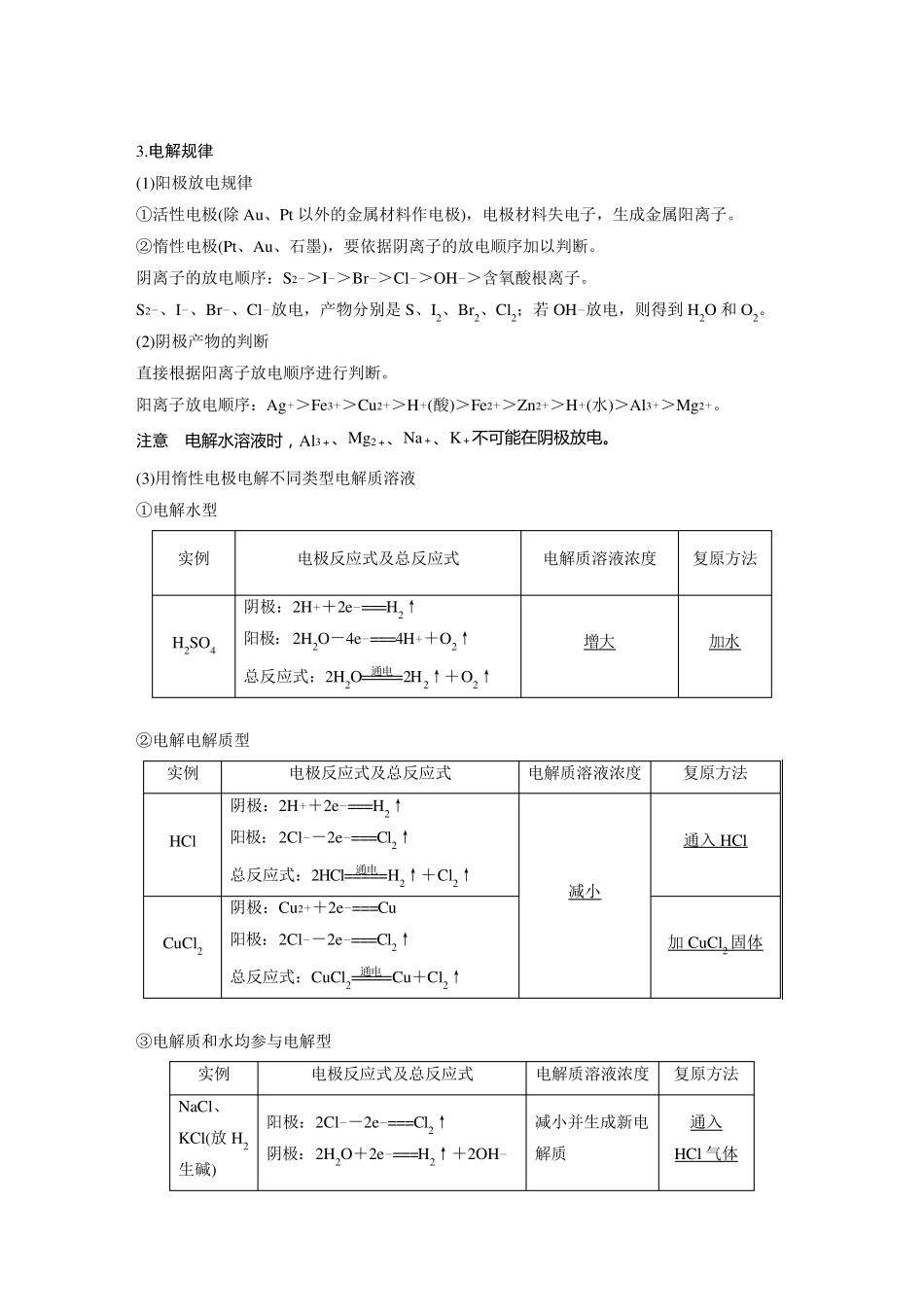
第38 讲 电解池 金属的腐蚀与防护 [复习目标] 1.理解电解池的工作原理,了解电解池与原电池的异同。2.理解电解的原理,掌握氯碱工业、电镀、铜的电解精炼、电冶金的反应原理。3.掌握常见离子放电顺序,熟练书写电极反应式、总反应式并能进行相关计算。4.认识金属腐蚀的危害,理解金属发生电化学腐蚀的原因,能选用恰当的措施防止金属腐蚀。 考点一 电解池及工作原理 1.电解池的工作原理 注意 电 子 不 下 水 , 离 子 不 上 线 。 2.电解池与原电池的比较 电解池 原电池 能否自发 使“不能”变为“能”或使“能”变为“易” 能自发进行 能量转化 电能转化为化学能 化学能转化为电能 装置 有外加电源 无外加电源 电极 由外加电源决定: 阳极:连电源的正极; 阴极:连电源的负极 由电极或反应物性质决定,称为正极或负极 反应 类型 阳极:氧化反应; 阴极:还原反应 负极:氧化反应; 正极:还原反应 离子移动 阳离子移向阴极; 阴离子移向阳极 阳离子移向正极; 阴离子移向负极 相同点 都是电极上的氧化还原反应,都必须有离子导体 3.电解规律 (1)阳极放电规律 ①活性电极(除Au、Pt 以外的金属材料作电极),电极材料失电子,生成金属阳离子。 ②惰性电极(Pt、Au、石墨),要依据阴离子的放电顺序加以判断。 阴离子的放电顺序:S2->I->Br->Cl->OH->含氧酸根离子。 S2-、I-、Br-、Cl-放电,产物分别是S、I2、Br2、Cl2;若OH-放电,则得到H2O 和O2。 (2)阴极产物的判断 直接根据阳离子放电顺序进行判断。 阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+。 注意 电 解 水 溶 液 时 , Al3+ 、Mg2+ 、Na+ 、K+ 不 可 能 在 阴 极 放 电 。 (3)用惰性电极电解不同类型电解质溶液 ①电解水型 实例 电极反应式及总反应式 电解质溶液浓度 复原方法 H2SO4 阴极:2H++2e-===H2↑ 阳极:2H2O-4e-===4H++O2↑ 总反应式:2H2O=====通电2H2↑+O2↑ 增大 加水 ②电解电解质型 实例 电极反应式及总反应式 电解质溶液浓度 复原方法 HCl 阴极:2H++2e-===H2↑ 阳极:2Cl--2e-===Cl2↑ 总反应式:2HCl=====通电H2↑+Cl2↑ 减小 通入HCl CuCl2 阴极:Cu2++2e-===Cu 阳极:2Cl--2e-===Cl2↑ 总反应式:CuCl2=====通电Cu+Cl2↑ 加CuCl2 固体 ③电解质和水均参与电解型...