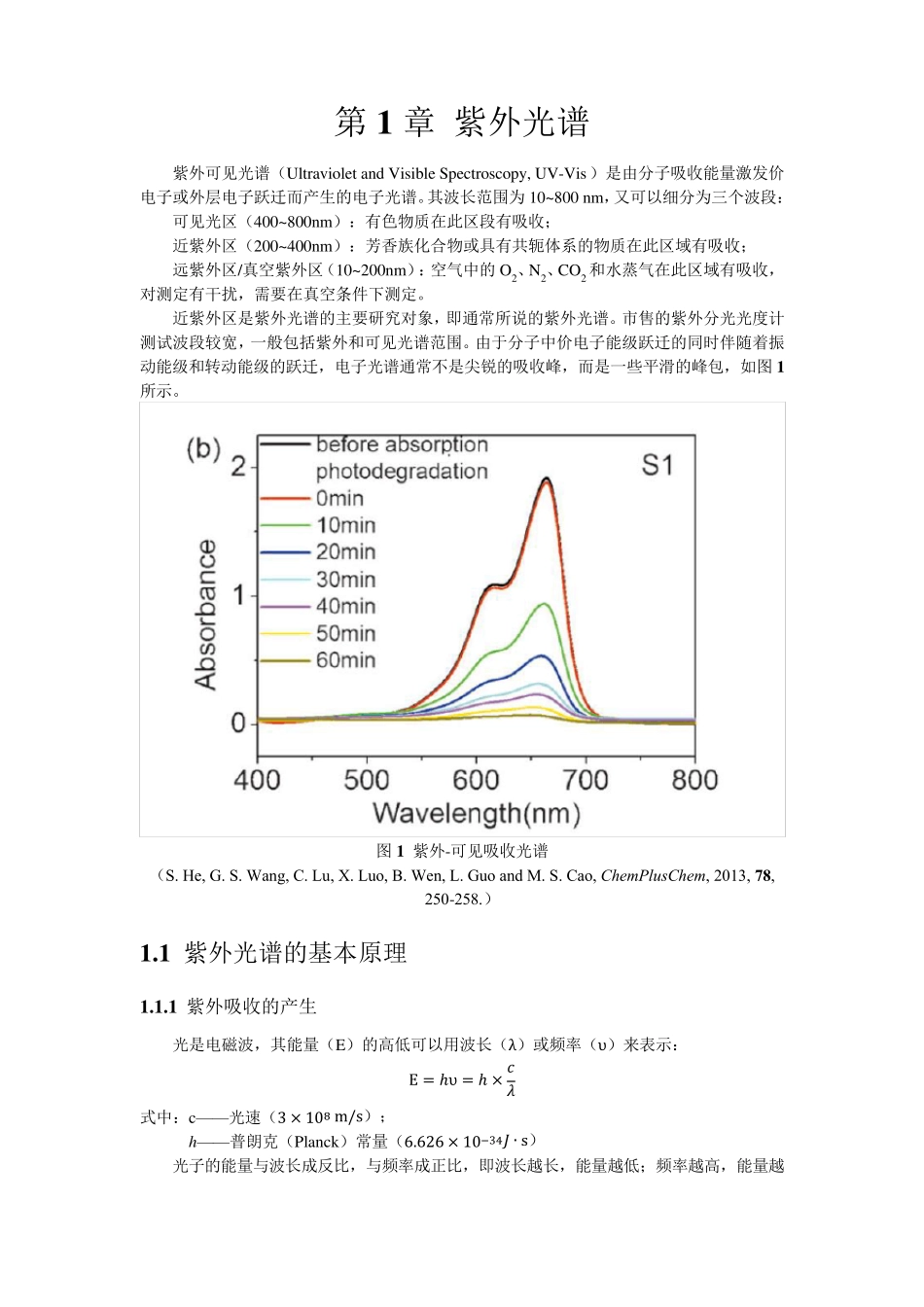
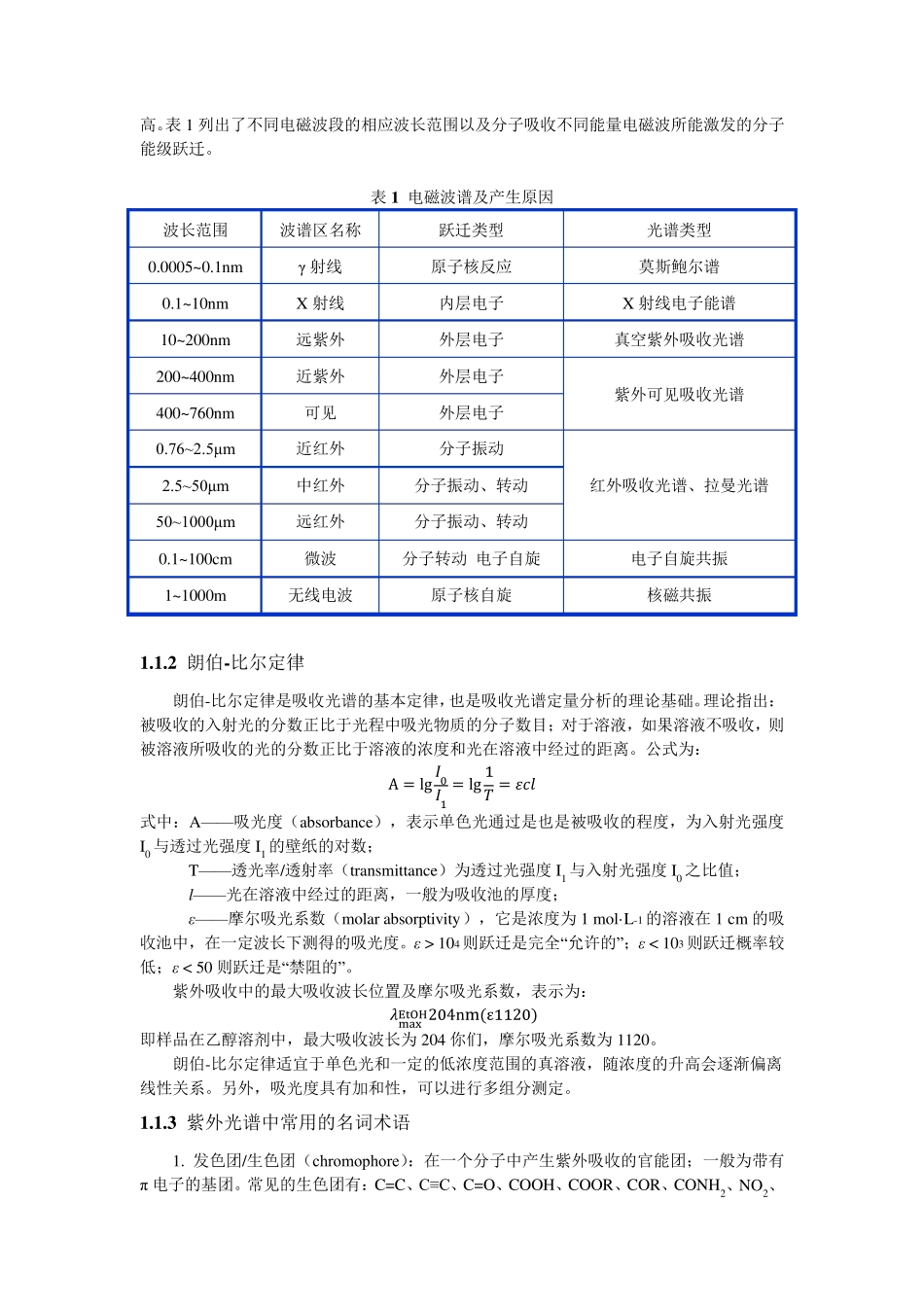
第1 章 紫外光谱 紫外可见光谱(Ultraviolet and Visible Spectroscopy, UV-Vis)是由分子吸收能量激发价电子或外层电子跃迁而产生的电子光谱。其波长范围为10~800 nm,又可以细分为三个波段: 可见光区(400~800nm):有色物质在此区段有吸收; 近紫外区(200~400nm):芳香族化合物或具有共轭体系的物质在此区域有吸收; 远紫外区/真空紫外区(10~200nm):空气中的O2、N2、CO2 和水蒸气在此区域有吸收,对测定有干扰,需要在真空条件下测定。 近紫外区是紫外光谱的主要研究对象,即通常所说的紫外光谱。市售的紫外分光光度计测试波段较宽,一般包括紫外和可见光谱范围。由于分子中价电子能级跃迁的同时伴随着振动能级和转动能级的跃迁,电子光谱通常不是尖锐的吸收峰,而是一些平滑的峰包,如图 1所示。 图 1 紫外-可见吸收光谱 (S. He, G. S. Wang, C. Lu, X. Luo, B. Wen, L. Guo and M. S. Cao, ChemPlusChem, 2013, 78, 250-258.) 1 .1 紫外光谱的基本原理 1 .1 .1 紫外吸收的产生 光是电磁波,其能量(E)的高低可以用波长(λ)或频率(υ)来表示: E = ℎυ = ℎ × ᵅᵰ 式中:c— — 光速(3 × 108 m/s); h— — 普朗克(Planck)常量(6.626 × 10−34ᵃ ∙s) 光子的能量与波长成反比,与频率成正比,即波长越长,能量越低;频率越高,能量越高。表1 列出了不同电磁波段的相应波长范围以及分子吸收不同能量电磁波所能激发的分子能级跃迁。 表1 电磁波谱及产生原因 波长范围 波谱区名称 跃迁类型 光谱类型 0.0005~0.1nm γ 射线 原子核反应 莫斯鲍尔谱 0.1~10nm X 射线 内层电子 X 射线电子能谱 10~200nm 远紫外 外层电子 真空紫外吸收光谱 200~400nm 近紫外 外层电子 紫外可见吸收光谱 400~760nm 可见 外层电子 0.76~2.5μm 近红外 分子振动 红外吸收光谱、拉曼光谱 2.5~50μm 中红外 分子振动、转动 50~1000μm 远红外 分子振动、转动 0.1~100cm 微波 分子转动 电子自旋 电子自旋共振 1~1000m 无线电波 原子核自旋 核磁共振 1 .1 .2 朗伯-比尔定律 朗伯-比尔定律是吸收光谱的基本定律,也是吸收光谱定量分析的理论基础。理论指出:被吸收的入射光的分数正比于光程中吸光物质的分子数目;对于溶液,如果溶液不吸收,则被溶液所吸收的光的分数正比于溶液的浓度和光在溶液中经过的距离。公式为: A ...