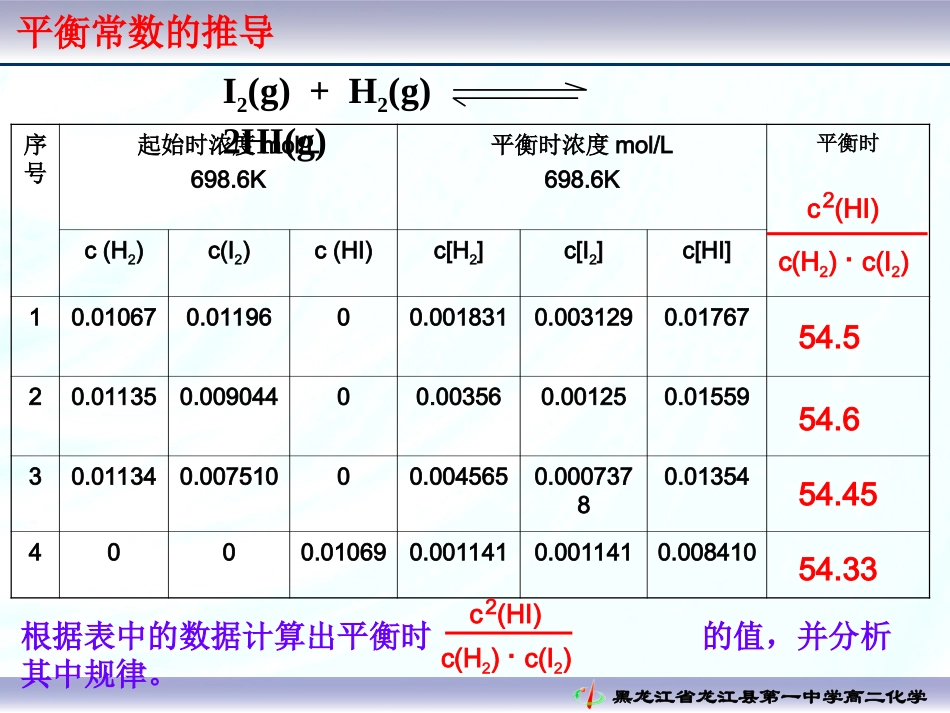
黑龙江省龙江县第一中学高二化学黑龙江省龙江县第一中学高二化学平衡常数的推导序号起始时浓度mol/L698.6K平衡时浓度mol/L698.6K平衡时c(H2)c(I2)c(HI)c[H2]c[I2]c[HI]10.010670.0119600.0018310.0031290.0176720.011350.00904400.003560.001250.0155930.011340.00751000.0045650.00073780.013544000.010690.0011410.0011410.008410I2(g)+H2(g)2HI(g)54.554.654.4554.33根据表中的数据计算出平衡时的值,并分析其中规律。c(HI)2c(H2)·c(I2)2c(HI)c(H2)·c(I2)黑龙江省龙江县第一中学高二化学1、定义:在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数。这个常数就是该反应的化学平衡常数(简称平衡常数)四、化学平衡常数黑龙江省龙江县第一中学高二化学浓度的单位为mol·L-1∴K的单位为(mol·L-1)n;2、平衡常数的数学表达式及单位:对于一般的可逆反应mA+nBpC+qD{c(C)}p{c(D)}q{c(A)}m{c(B)}nK=黑龙江省龙江县第一中学高二化学㈠、如果反应中有固体和纯液体参加,它们的浓度不应写在平衡关系式中,因为它们的浓度是固定不变的,化学平衡关系式中只包括气态物质和溶液中各溶质的浓度。如:CaCO3(s)CaO(s)+CO2(g)K=[CO2]CO2(g)+H2(g)CO(g)+H2O(l)K=[CO]/([CO2][H2])3、书写平衡常数关系式的规则黑龙江省龙江县第一中学高二化学例N2(g)+3H2(g)2NH3(g)K1=1.601051/2N2(g)+3/2H2(g)NH3(g)K2=3.87102K1K2,K1=K22㈡、同一化学反应,可以用不同的化学反应式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。3、书写平衡常数关系式的规则黑龙江省龙江县第一中学高二化学4、平衡常数的意义定量的衡量化学反应进行的程度(1)K值越大,表示反应进行的程度越大,反应物转化率也越大。(2)一般当K>105时,该反应进行得基本完全。黑龙江省龙江县第一中学高二化学(1)内因:反应物的本身性质(2)外因:反应体系的温度5、化学平衡的影响因素6、判断可逆反应是否达到平衡及反应向何方向进行对于可逆反应mA+nBpC+qD,在一定的温度的任意时刻,反应物的浓度和生成物的浓度有如下关系:叫该反应的浓度商{c(C)}p{c(D)}q{c(A)}m{c(B)}n=Q(1)QC<K,反应向正方向进行(2)QC=K,反应处于平衡状态(3)QC>K,反应向逆方向进行黑龙江省龙江县第一中学高二化学7、利用K可判断反应的热效应(1)若升高温度,K值增大,则正反应为吸热反应(2)若升高温度,K值减小,则正反应为放热反应思考题化学平衡常数有固定的单位吗?由平衡常数的表达式可知,其单位取决可逆反应中反应物和生成物种类和化学方程式中对应系数大小,故化学平衡常数没有固定单位。温度越高,k越大吗?正反应为吸热反应,升高温度,K会变大正反应为放热反应,升高温度,K会变小黑龙江省龙江县第一中学高二化学8、有关化学平衡常数的计算达到平衡后各物质的浓度变化关系:(2)生成物:平衡浓度=初始浓度+转化浓度生成物D:c平(D)=c0(D)+△c(D)(3)各物质的转化浓度之比等于它们在化学方程式中相应的化学计量数之比。△c(A):△c(D)=a:d(1)反应物:平衡浓度=初始浓度-转化浓度;反应物A:c平(A)=c0(A)-△c(A)对于反应:aA+bBcC+dD黑龙江省龙江县第一中学高二化学概念理解:平衡转化率用平衡常数来表示反应的限度有时不够直观,常用平衡转化率α来表示反应限度。对于可逆反应:mA(g)+nB(g)pC(g)+qD(g)反应物A的平衡转化率(该条件最大转化率)可表示:黑龙江省龙江县第一中学高二化学(1)已知初始浓度和平衡浓度求平衡常数和平衡转化率例1:在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得C(H2)=0.0080mol/L.(1)求该反应的平衡常数(2)在上述温度下,该容器中若通入H2和I2蒸汽各0.20mol.试求达到化学平衡状态时各物质的浓度.9、有关化学平衡常数的计算例题黑龙江省龙江县第一中学高二化学H2+I22HI≒解(1)根据题意得:平衡浓度mol/L:0.00800.00800.0040起始浓度mol/L:0.010.010K=C(HI)2C(H2)C(I2)=0.25解(2)设H2的消耗浓度为xH2+I22HI≒平衡浓度mol/L:0.02-x0.02-x2x起始浓度mol/L:0.020.020K=C(HI)2C(H2)C(I...