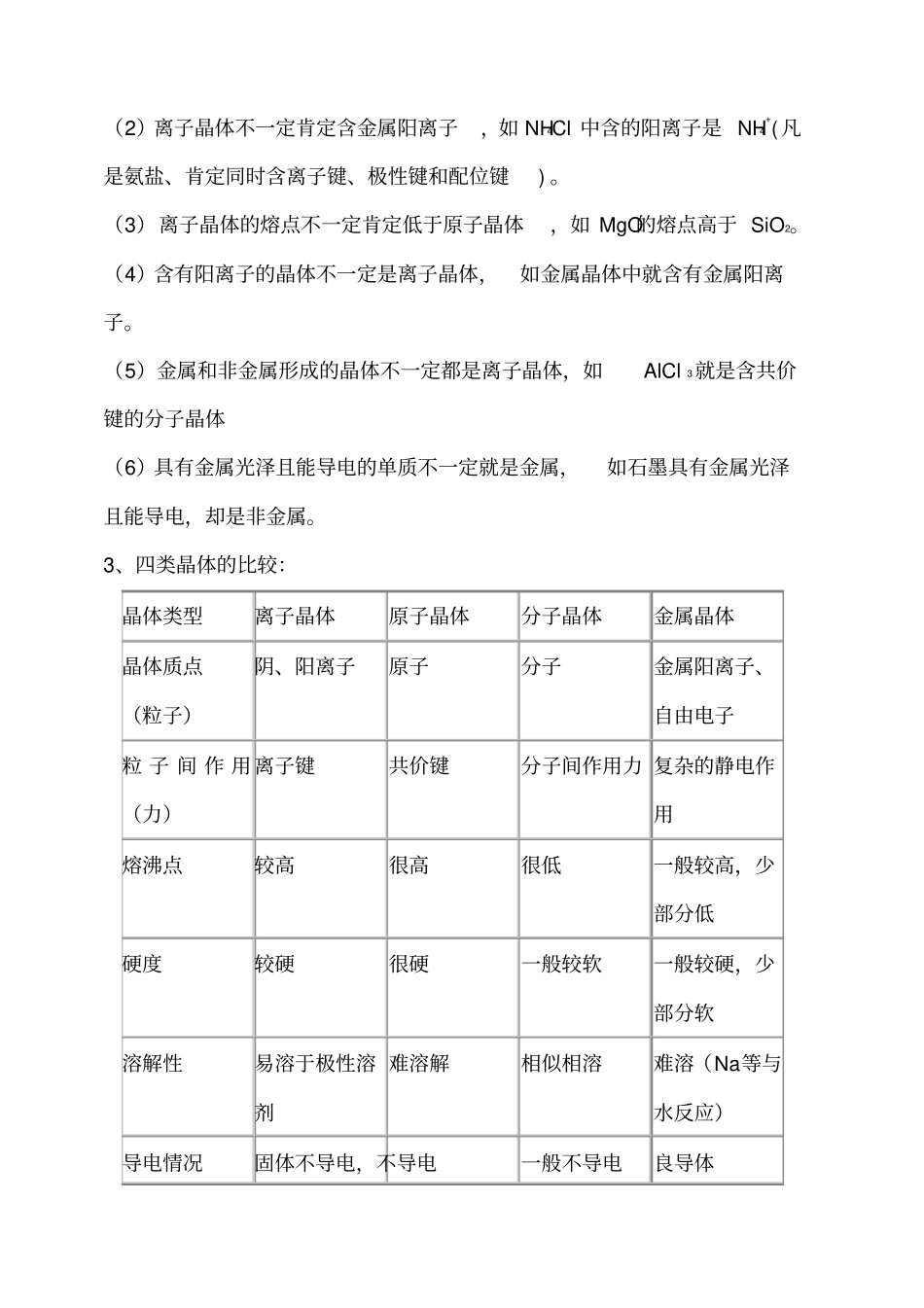
晶 体 类 型 的 判 断 与 比 较 , 晶 体 结 构 的 计 算 ,怎 样 比 较 熔 点 的 高 低 ,8 晶体类型的判断与比较1、判断晶体类型的方法(1)依据物质的分类判断金属氧化物(如K2O、Na2O2 等),强碱(如 NaCl、KOH等)和绝大多数的盐类是离子晶体。大多数非金属单质 (除金刚石、 石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)是分子晶体 。常见的原子晶体单质有金刚石、石墨、晶体硅、晶体硼等;常见的原子晶体化合物有碳化硅、二氧化硅等。金属单质(除汞外)与合金都是金属晶体。(2)依据物质的性质判断离子晶体的熔点较高,常在数百至1000 余度;原子晶体熔点高,常在1000 度至几千度;分子晶体熔点低,常在数百度以下至很低温度;金属晶体多数熔点高,但也有相当低的。离子晶体水溶液及熔化时能导电,晶体不导电;原子晶体一般为非导体,但石墨等导电;分子晶体为非导体,而分子晶体中的电解质(主要是酸和非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子也能导电,但熔化不导电,金属晶体是良导体。2、晶体中的几个不一定(1)离子晶体除含离子键外不一定不含其他化学键。如氨盐中除含离子键,还含极性键和配位键; Na2O2中除含离子键还含非极性键。(2)离子晶体不一定肯定含金属阳离子,如 NH4Cl 中含的阳离子是 NH4+(凡是氨盐、肯定同时含离子键、极性键和配位键) 。(3)离子晶体的熔点不一定肯定低于原子晶体,如 MgO的熔点高于 SiO2。(4)含有阳离子的晶体不一定是离子晶体,如金属晶体中就含有金属阳离子。(5)金属和非金属形成的晶体不一定都是离子晶体,如AlCl 3就是含共价键的分子晶体(6)具有金属光泽且能导电的单质不一定就是金属,如石墨具有金属光泽且能导电,却是非金属。3、四类晶体的比较:晶体类型离子晶体原子晶体分子晶体金属晶体晶体质点(粒子)阴、阳离子原子分子金属阳离子、自由电子粒 子 间 作 用(力)离子键共价键分子间作用力 复杂的静电作用熔沸点较高很高很低一般较高,少部分低硬度较硬很硬一般较软一般较硬,少部分软溶解性易溶于极性溶剂难溶解相似相溶难溶(Na等与水反应)导电情况固体不导电,不导电一般不导电良导体熔化或溶于水后导电(除硅)事例NaCl、CaCO3NaOH等金刚石、水晶、碳化硅等干冰、冰、纯硫酸、 H2(S) Na、Mg、Al 等9 怎样比较熔点的高低1)先看晶体的类...