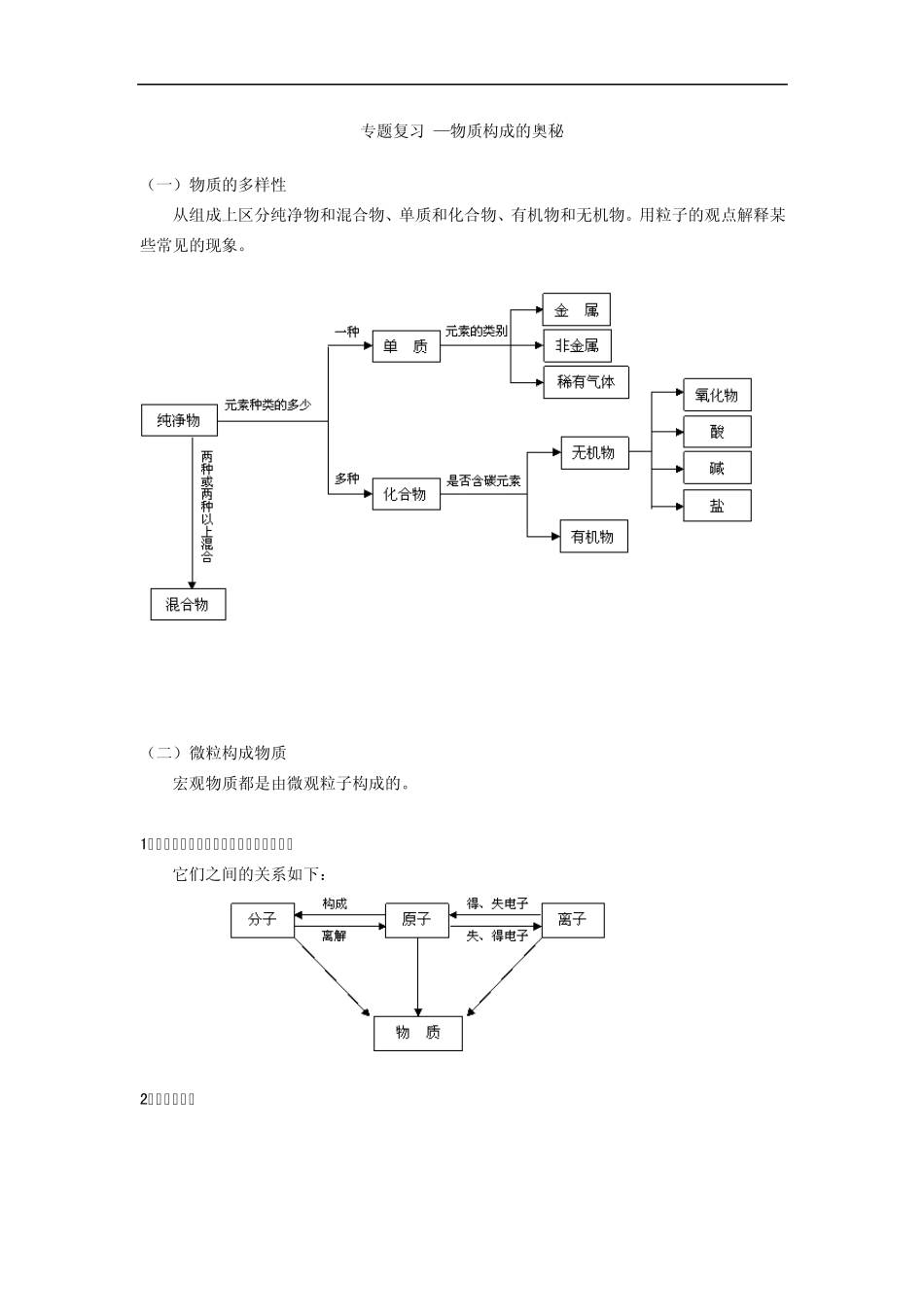
专题复习 —物质构成的奥秘 (一)物质的多样性 从组成上区分纯净物和混合物、单质和化合物、有机物和无机物。用粒子的观点解释某些常见的现象。 (二)微粒构成物质 宏观物质都是由微观粒子构成的。 1.分子、原子、离子都是构成物质的粒子 它们之间的关系如下: 2.原子的构成 (1)质子数=核电荷数=原子序数=核外电子数,原子不显电性。 (2)质子数+中子数=相对原子质量(数值),原子的质量主要集中在原子核上。 (3)不是所有原子的原子核都有中子。 (4)核外电子是分层排布的(认识原子结构示意图)。 3.分子和原子的本质区别 (1)分子的定义:分子是保持物质化学性质的最小粒子。 提示:分子在物理变化中不可分,分子间的距离可变化;分子在化学变化中可分,构成分子的原子可重新组合,构成新的分子。 原子的定义:原子是化学变化中的最小粒子。 提示:原子在化学变化中不可分,但原子可重新组合。 (2)认识分子的主要性质,并能用分子的性质解释一些基本问题。 a.分子的体积和质量都很小 b.分子总是在不停地运动 c.分子间有一定的间隔 d.分子在化学变化中可分 (三)化学元素 1.定义:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。 已经发现的元素有一百余种。地壳里和生命细胞中含量最多的元素是氧。地壳里含量较多的元素还有:硅、铝、铁、钙、钠、钾、镁等;生命细胞中含量较多的元素还有:碳、氢、氮、钙、磷等。 2.两个决定: 在原子结构中,核内质子数决定元素的种类;最外层电子数主要决定元素的化学性质。 3.元素的简单分类:金属元素、非金属元素和稀有气体元素。 元素的简单分类 最外层电子数 化学性质 金属元素 一般为 1~3个 较易失电子形成阳离子 非金属元素 一般为 5~7个 较易得电子形成阴离子 稀有气体元素 8个(氦为 2个) 化学性质稳定 4.一些常见元素的名称和符号 5.提示:元素只论种类,不论个数。 (四)物质组成的表示 1.物质的构成 2.物质组成的表示 3.化学式:表示物质的组成。 纯净物的组成是固定不变的,一种物质只有一个化学式。 4.化学式与化合价的关系 根据化学式可以推算化合价,根据化合价可以书写化学式。 (1)在单质里,元素的化合价为零。 (2)在化合物里,正负化合价的代数和为零。 5.化学式的涵义(以H2O 为例) 可以从宏观和微观来理解它的涵义。 宏观:(1)表示水这种物质。 (2)表示水是由氢元素和氧元素组成的。...