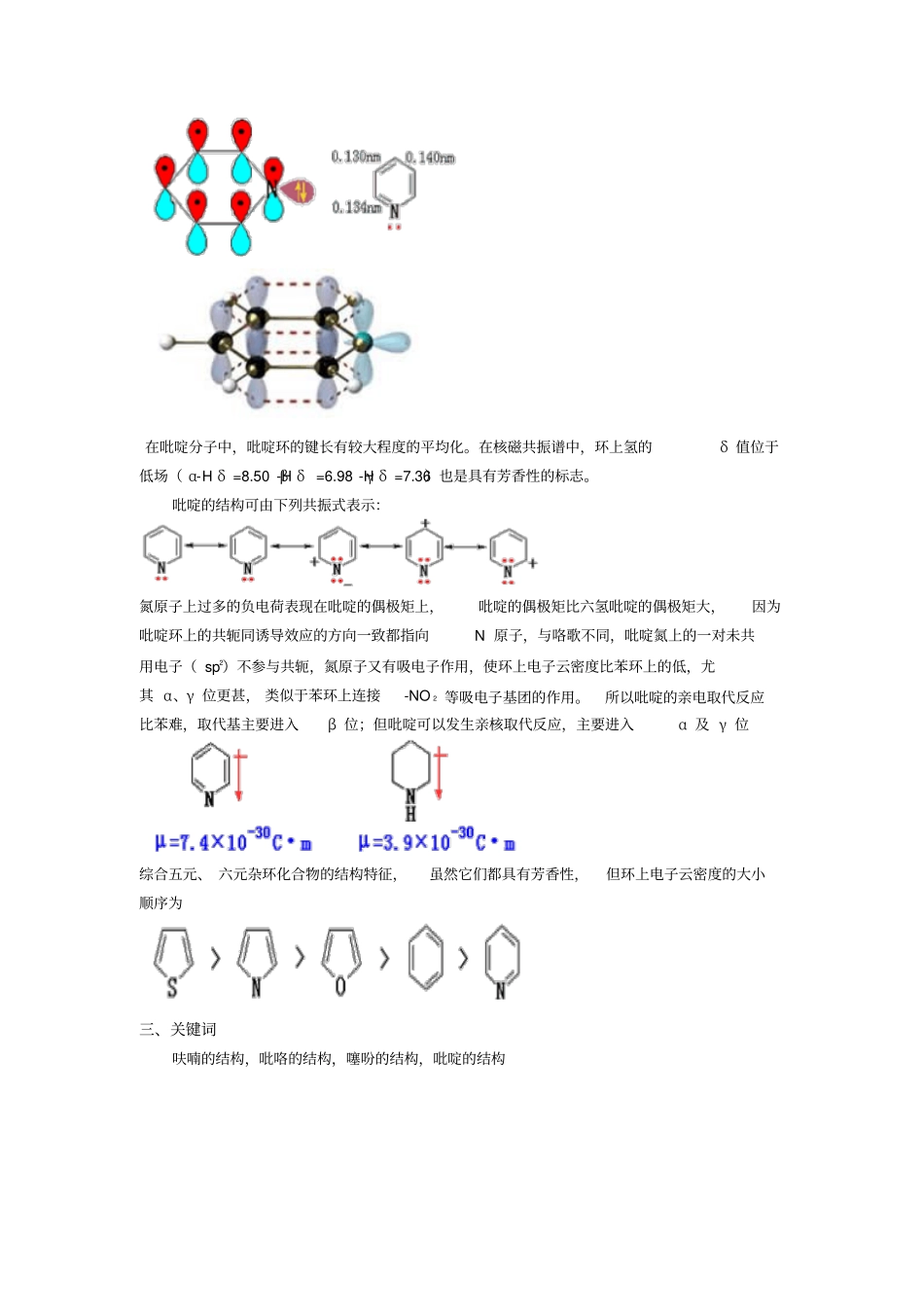
首页 — >杂环化合物 — >M 2 杂环化合物的结构与芳香性杂环化合物的结构与芳香性化教学目标 :掌握杂环合物的结构与芳香性教学重点 :杂环化合物的结构教学安排: G1,G 2,M 1— >M 2;50min 一、五元单杂环化合物的结构和芳香性五元单杂环如呋喃、噻吩、吡咯,在结构上,都符合Huckel 的关于芳香性的规则,即环上原子共平面, 彼此以σ 键相连接, 四个碳原子各有一个电子在p 轨道上, 杂原子有两个电子在p 轨道上, 这些p 轨道都垂直于σ 键所在的平面, 相互重叠形成大π 键—— 闭和的共轭体系,π 电子数目为4n+2。结构如图所示:呋喃、 噻吩和吡咯具有芳香性还可以从分子偶极矩看出。在非芳香性杂环中只有诱导效应,而在相应的芳香杂环中除诱导效应外,还有共轭效应,并且两者的方向相反。μ =5.77x10-30C· mμ =6.33x10-30C· mμ =5.27x10-30C· m 在呋喃、噻吩、吡咯杂环中,由于杂原子不同,显示的芳香性也不完全一致。键长的平均化程度也不一样。实测的键长数据如下:典型的键长数据为:C-C 0.154nm C-O 0.143nm C-S 0.182nm C-N 0.147nm C=C 0.134nm C=O 0.122nm C=S 0.160nm C=N 0.128nm 由此可见:1)五元杂环分子中的键长有一定的平均化,但不像苯那样完全平均化,因此芳香性较苯环差,有某种程度的不饱和化合物的性质和环的不稳定性;2)杂原子有给电子性,环上电子云密度比苯环上的高,因此比苯更容易发生亲电取代反应,取代主要发生在α 位,其活性相当于苯环上连接-OH 、-SH、-NH 2;3)由于杂原子的电负性为O>N>S, 它们的给电子能力为S>N>O, 所以环上电子云密度的大小顺序为:它们的离域能分别为117KJ· mol-1,88KJ· mol-1,67kJ·mol-1 也说明了这点。如呋喃就表现出某些共轭二烯的性质,可以进行双烯加成反应,有介于芳香族及不饱和脂肪族化合物之间的某些特征。4)综上所述,它们的芳香性由强到弱的顺序为:核磁共振谱的测定表明,环上氢的化学位移都出现在低场,这也是它们具有芳香性的一个标志:呋喃α-H δ =7.42β-H δ =6.37噻吩α-H δ =7.30β-H δ =7.10吡咯α-H δ =6.68 β-H δ =6.22二、六元单杂环化合物的结构和芳香性吡啶具有六元单杂环的典型结构和苯的结构很相似,是苯中的一个碳原子被氮原子代替,氮原子以sp2 杂化轨道和两个相邻碳原子的sp2 杂化轨道形成两个σ 键。环上每个原子均有一个p 轨道垂直于环的平面,组成...