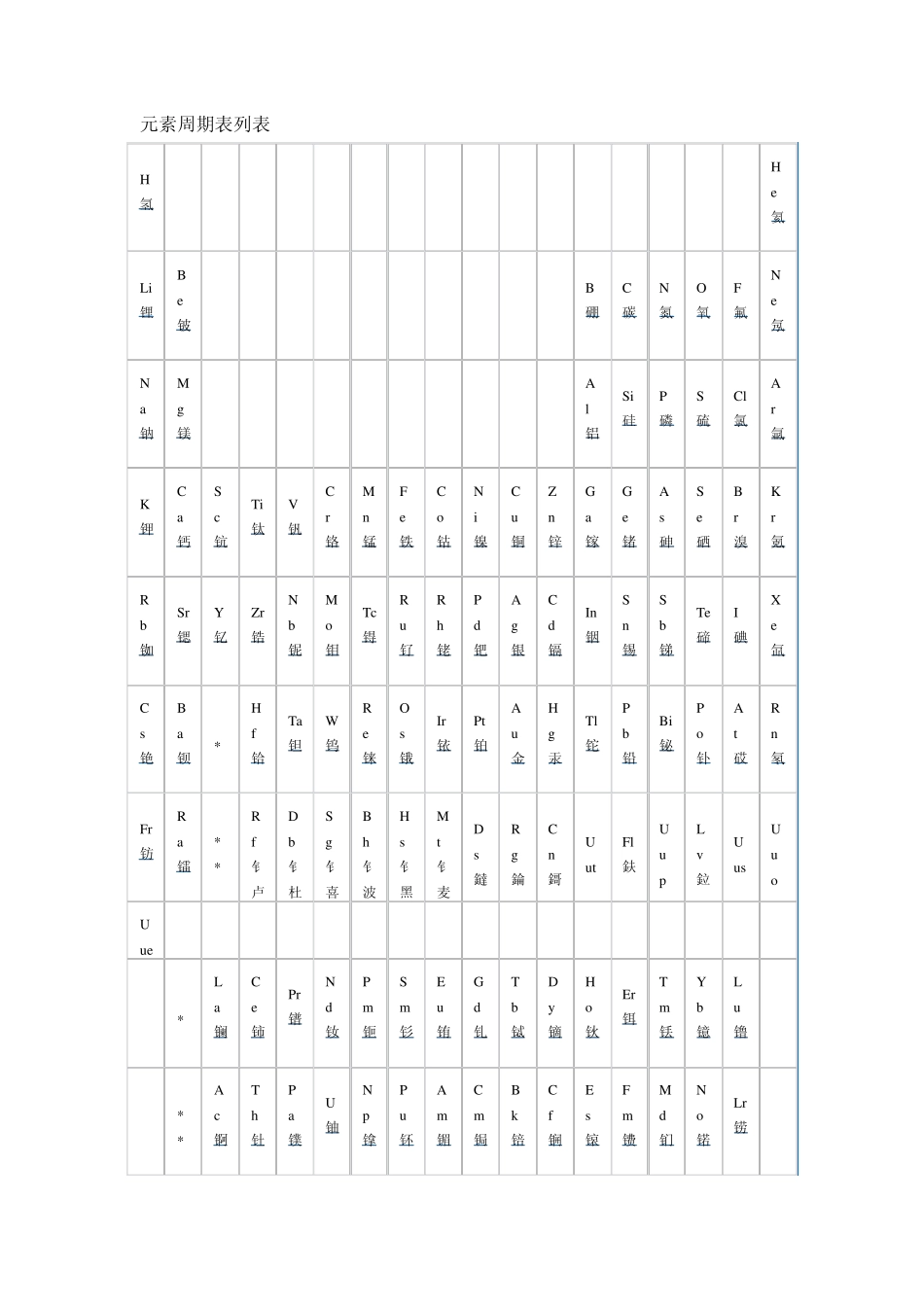
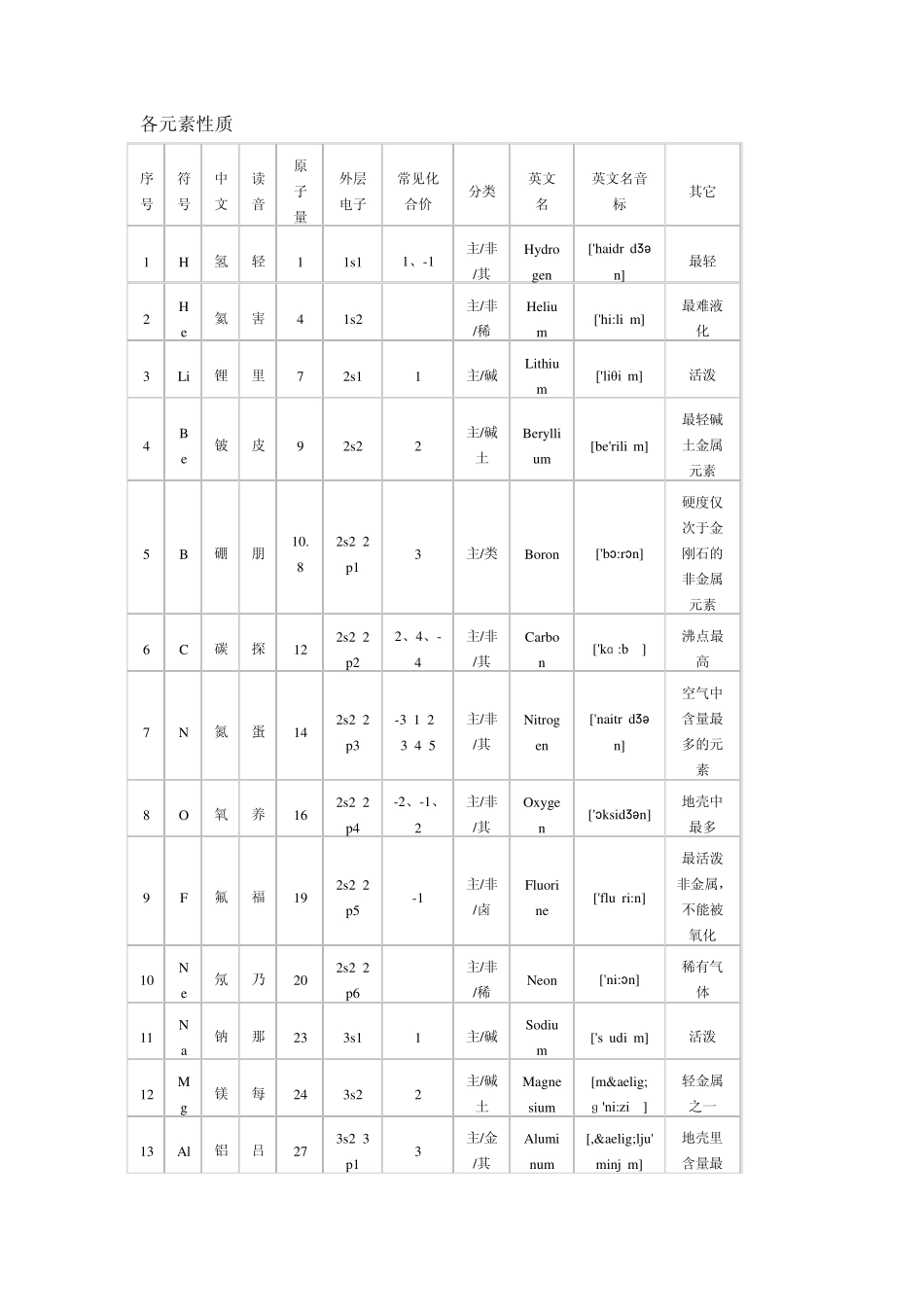
化学教科书中,都附有一张“元素周期表(英文:periodic table of elements)”。这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。看到这张表,人们便会想到它的最早发明者——门捷列夫。1869 年,俄国化学家门捷列夫按照相对原子质量由小到大排列,将化学性质相似的元素放在同一纵行,编制出第一张元素周期表。元素周期表揭示了化学元素之间的内在联系,使其构成了一个完整的体系,成为化学发展史上的重要里程碑之一。随着科学的发展,元素周期表中未知元素留下的空位先后被填满。当原子结构的奥秘被发现时,编排依据由相对原子质量改为原子的核电荷数,形成现行的元素周期表。 按照元素在周期表中的顺序给元素编号,得到原子序数。原子序数跟元素的原子结构有如下关系: 原子数=原子序数=核外电子数=核电荷数 利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。1913 年英国科学家莫色勒利用阴极射线撞击金属产生 X 射线,发现原子序越大,X 射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷 (即质子数或原子序)排列.后来又经过多名科学家多年的修订才形成当代的周期表。 门捷列夫第一份英文版本的元素周期表. 元素周期表中共有119 种元素。将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵列。每一种元素都有一个序号,大小恰好等于该元素原子的核内质子数,这个序号称为原子序数。在周期表中,元素是以元素的原子序排列,最小的排行最前。表中一横行称为一个周期,一列称为一个族(8、9、10 纵行为一个族) 原子的核外电子排布和性质有明显的规律性,科学家们是按原子序数递增排列,将电子层数相同的元素放在同一行,将最外层电子数相同的元素放在同一列。 元素周期表有7 个周期,16 个族。每一个横行叫作一个周期,每一个纵行叫作一个族。这7个周期又可分成短周期(1、2、3)、长周期(4、5、6)和不完全周期(7)。共有16 个族,又分为 7 个主族(ⅠA-ⅦA),7 个副族(ⅠB-ⅦB),一个第Ⅷ族,一个零族。 元素周期表 元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。使其构成了一个完整的体系称为化学发展的重要里程碑之一。 同一周期内,从左到...