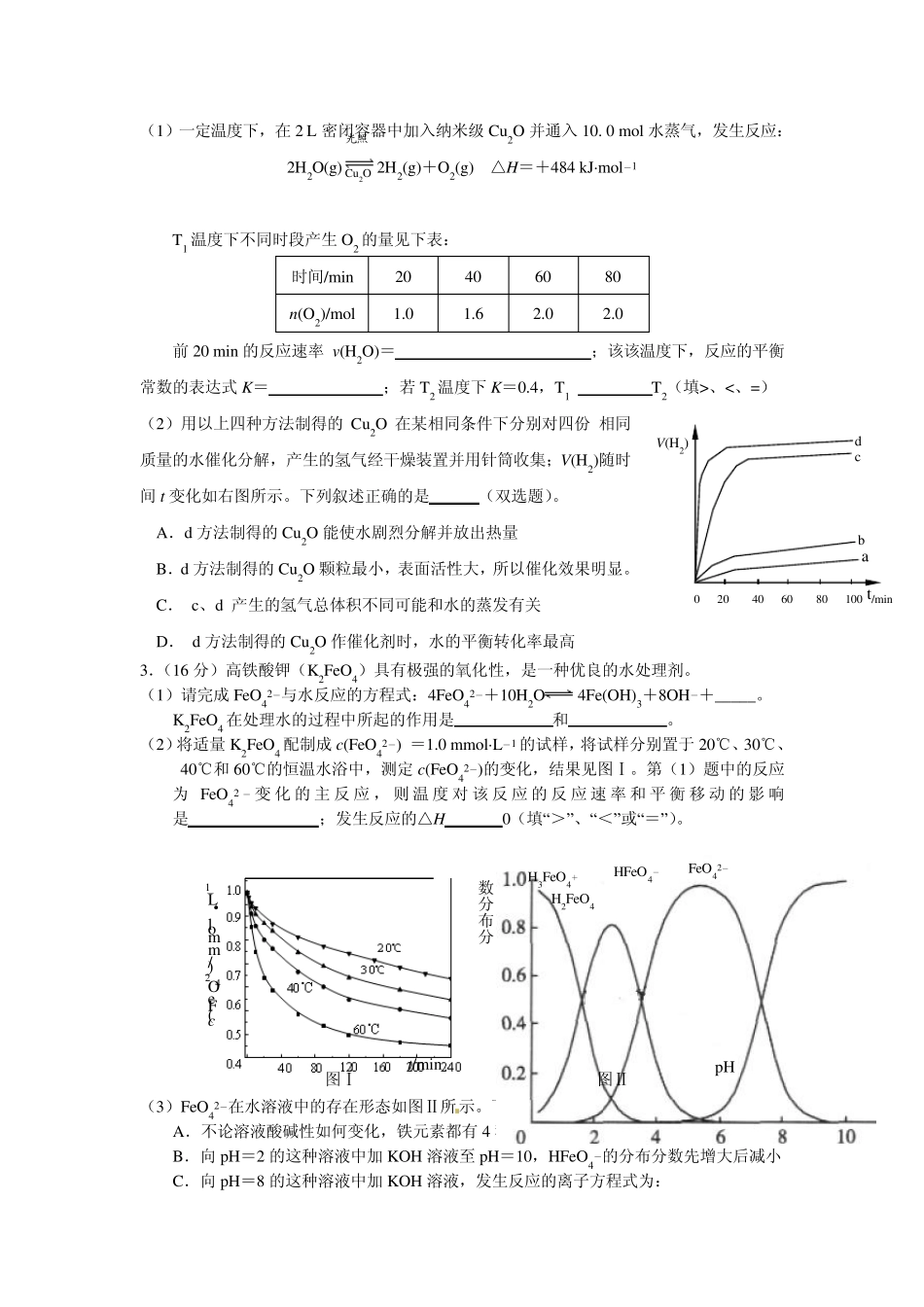
化学反应原理大题练习 1.(16 分)苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是: C6H5C2H5(g)C6H5CH=CH2(g)+H2 (g) △H=+125kJ·mol-1 (1)该反应的平衡常数表达式为 K= __ _____________ 。随着温度的升高,K 值________(填“增大”、“减小”或“不变”,下同)。 (2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。C6H5C2H5的平衡转化率与水蒸气的用量、体系总压强关系如下图。 ①由上图可得出: 结论一:其他条件不变,水蒸气的用量越大,平衡转化率越______; 结论二:__________________________________________________。 ②加入稀释剂能影响 C6H5C2H5 平衡转化率的原因是:_______________________。 (3)某些工艺中,在反应的中途加入 O2 和特定的催化剂,有利于提高 C6H5C2H5 的平衡转化率。试解释其原因:_______________________________________________。 2.(16 分)科学研究发现纳米级的 Cu2O 可作为太阳光分解水的催化剂。 Ⅰ.四种制取Cu2O 的方法 (a)用炭粉在高温条件下还原 CuO 制备 Cu2O; (b)用葡萄糖还原 悬浊液制备 Cu2O; (c)电解法制备 Cu2O。原理如右图所示,反应为:2Cu+H2O=Cu2O+H2↑,则铜作为 极; (d)最新实验研究加热条件下用液态肼(N2H4)还原新制 Cu(OH)2 可制备纳米级Cu2O,同时放出 N2 和水蒸气。该制法的化学方程式为 。 Ⅱ.用制得的Cu2O 进行催化分解水的实验 平衡转化率/% 101kPa(900K) 40 60 80 4 8 12 16 20 202kPa(900K) n(H2O) n(C6H5C2H5) 0 (1)一定温度下,在 2 L 密闭容器中加入纳米级 Cu2O 并通入 10. 0 mol 水蒸气,发生反应: 2H2O(g)2H2(g)+O2(g) △H=+484 kJ·mol-1 T1 温度下不同时段产生 O2 的量见下表: 时间/min 20 40 60 80 n(O2)/mol 1.0 1.6 2.0 2.0 前 20 min 的反应速率 v (H2O)= ;该该温度下,反应的平衡常数的表达式 K= ;若 T2 温度下 K=0.4,T1 T2(填>、<、=) (2)用以上四种方法制得的 Cu2O 在某相同条件下分别对四份 相同质量的水催化分解,产生的氢气经干燥装置并用针筒收集;V(H2)随时间 t 变化如右图所示。下列叙述正确的是 (双选题)。 A.d 方法制得的 Cu2O 能使水剧烈分解并放出热量 B.d 方法制得的 Cu2O 颗粒最小,表面活性大,所以催化效果明显。 C....