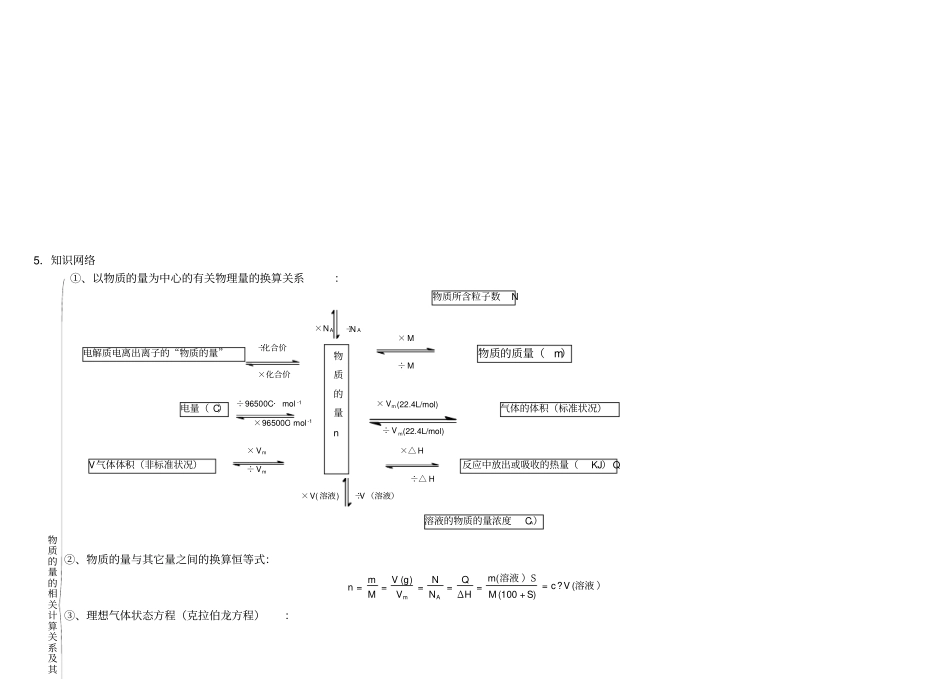
第八讲物质的量的浓度1.复习重点1.物质的量浓度的概念及有关计算;2.溶解度的概念及有关计算;3.物质的量浓度、质量分数和溶解度之间的相互换算;4.配制一定物质的量浓度溶液的方法和技能。5.高考的热点是物质的量浓度的概念及其计算,一定物质的量浓度的溶液的配制方法。2.难点聚焦1.物质的量浓度。浓度是指一定温度、压强下,一定量溶液中所含溶质的量的多少。常见的浓度有溶液中溶质的质量分数,溶液中溶质的体积分数,以及物质的量浓度。物质的量浓度是以单位体积溶液里所含溶质B 的物质的量来表示溶液组成的物理量。符号用cB表示, (2) 表达式: CB 单位常用 mol/L 或 mol/m3,注意:①单位体积为溶液的体积,不是溶剂的体积。②溶质必须用物质的量来表示。计算公式为概念中的单位体积一般指1 升,溶质 B 指溶液中的溶质,可以指单质或化合物,如 c(Cl 2)=0.1mol/L , c(NaCl)=2.5mol/L ;也可以指离子或其它特定组合,如c(Fe2+)=0.5mol/L, c(SO42-)=0.01mol/L等。2.溶液的稀释与混合 (1) 溶液的稀释定律由溶质的质量稀释前后不变有:mB =m 浓×ω浓=m稀×ω稀% 由溶质稀释前后物质的量不变有:CB =c浓×V 浓=c 稀×V 稀% (2) 溶液在稀释或混合时,溶液的总体积不一定是二者混合的体积之和。如给出溶液混合后的密度,应根据质量和密度求体积。3.物质的量浓度与溶质质量分数ω %的换算 ( ρ为该溶液的密度) 4.一定物质的量浓度溶液的配制(1) 仪器:容量瓶,容量瓶有各种不同的规格,一般有100mL、250mL、500mL和 1000mL等几种。 (2) 步骤:①计算:计算所需固体溶质质量或液体溶质的体积。②用托盘天平称量固体溶质或用量筒量取液体体积。③溶解:将溶质加入小烧杯中,加适量水溶解。④移液洗涤:将已溶解而且冷却的溶液转移到容量瓶中,并用玻璃棒引流,再洗涤烧杯和玻璃棒2— 3 次,将洗涤液倒入容量瓶中。⑤定容:缓缓向容量瓶中注入蒸馏水,直到容量瓶液面接近刻度线1cm-2cm 时,改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切,盖好,反复上下颠倒,摇匀。最后将容量物质的量浓度 dream 第 1 页 5/5/2020瓶中溶液转移到试剂瓶中备用。5.知识网络①、以物质的量为中心的有关物理量的换算关系:物质所含粒子数N 电解质电离出离子的“物质的量”物质的质量( m)电量( C)气体的体积(标准状况)V气体体积(非标准状况)反应中放出或吸收的热量(KJ) Q 溶液...