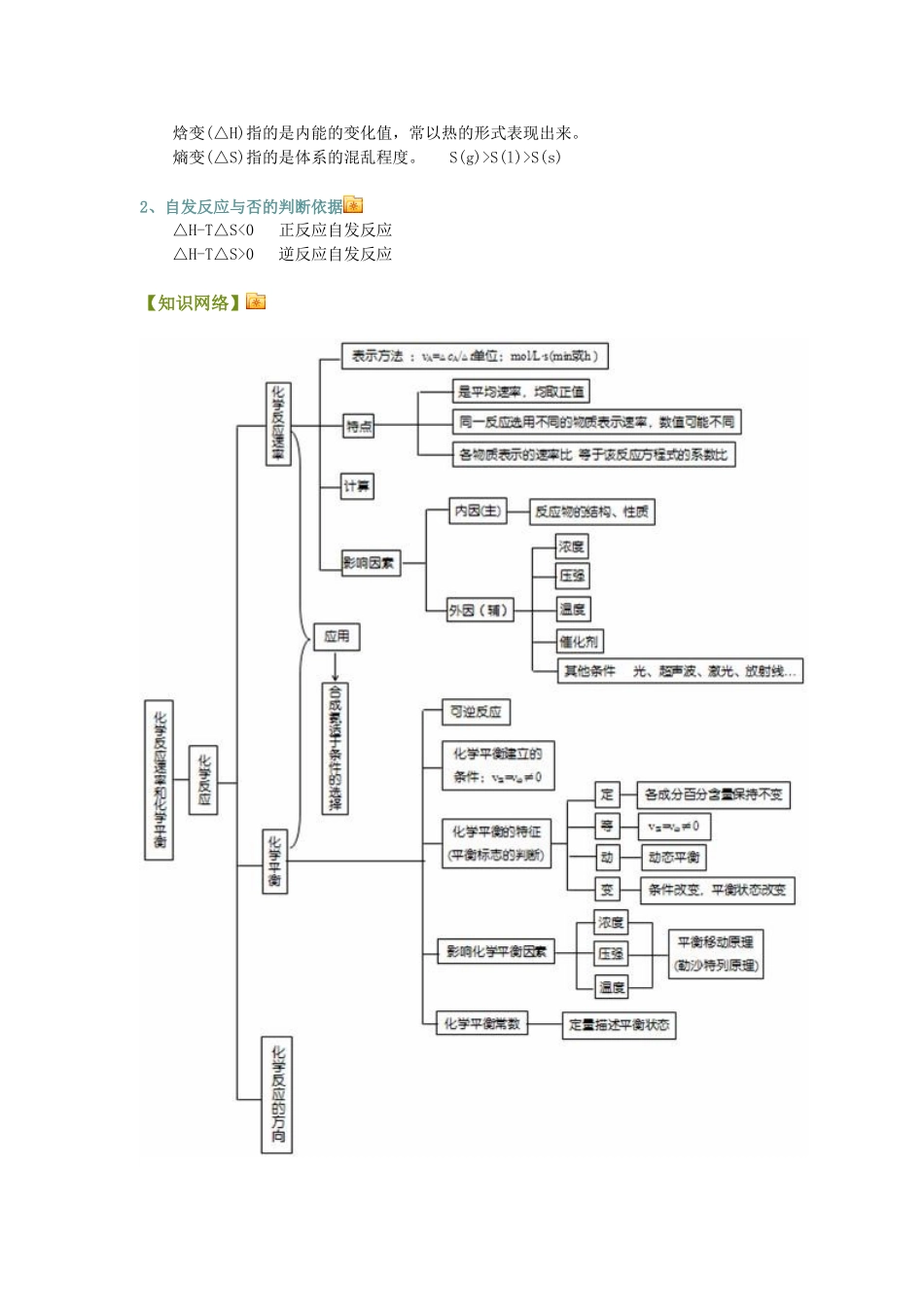
化学反应速率全章复习与巩固撰稿:牟建农审稿:张立责编:宋杰【重点聚焦】一、化学反应速率1.化学反应速率的概念及表示方法(1)概念:通常用单位时间里反应物浓度的减少或生成物浓度的增加来表示.(2)表达式:(3)单位:mol·L-1·min-1或mol·L-1·s-1等.(4)注意点:①化学反应速率均取正值.②化学反应速率一般不用固体物质表示.③同一反应,选用不同物质的浓度变化表示反应速率,数值可能不同,但意义相同,各物质表示的速率之比等于该反应方程式中的化学计量数之比.④注意区别平均速率和即时速率.2.影响化学反应速率的因素(1)内因:反应物的结构、性质.(2)外因:①浓度:增大反应物的浓度,反应速率增大.②温度:升高温度,反应速率增大.③压强:对于有气体参加的反应,增大压强,气体物质的浓度增大,反应速率增大.④催化剂:使用催化剂,反应速率增大.二、化学平衡(1)可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应.(2)化学平衡的概念:是指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态.(3)化学平衡的特征:①逆:可逆反应②等:v(正)=v(逆)③动:动态平衡v(正)=v(逆)≠0④定:平衡状态时反应混合物中各组分的浓度保持不变⑤变:当浓度、温度、压强等条件改变时,化学平衡即发生移动三、化学平衡的移动及影响因素1.化学平衡的移动(1)定义:可逆反应中旧化学平衡的破坏,新化学平衡的建立过程叫做化学平衡的移动.(2)化学平衡移动的本质原因是v(正)≠v(逆).如催化剂能同等程度改变v(正)和v(逆),所以,加入催化剂,化学平衡不发生移动.2.影响化学平衡的条件条件的变化平衡移动的方向平衡移动的结果(均与改变条件时比较)①浓度向正反应方向移动向逆反应方向移动②压强(气体)增大减小向缩小气体体积方向移动向增大气体体积方向移动使气体压强减小使气体压强增大③温度升高降低向吸热方向移动向放热方向移动使温度降低使温度升高3.化学平衡移动原理(即勒夏特列原理)如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.四、化学平衡常数与转化率1、化学平衡常数:对于一般的可逆反应:mA+nBpC+qD。其中m、n、p、q分别表示化学方程式中个反应物和生成物的化学计量数。当在一定温度下达到化学平衡时,这个反应的平衡常数可以表示为:k=在一定温度下,可逆反应达到化学平衡时,生成物的浓度,反应物的浓度的关系依上述规律,其常数(用K表示)叫该反应的化学平衡常数2、化学平衡常数的意义①平衡常数的大小不随反应物或生成物的改变而改变,只随温度的改变而改变。②可以推断反应进行的程度。K很大,反应进行的程度很大,转化率大K的意义K居中,典型的可逆反应,改变条件反应的方向变化。K很小,反应进行的程度小,转化率小3、转化率:可逆反应到达平衡时,某反应物的转化浓度(等于某反应物的起始浓度和平衡浓度的差)与该反应物的起始浓度比值的百分比。可用以表示可逆反应进行的程度。五、化学反应进行的方向1、焓变和熵变的不同:焓变(△H)指的是内能的变化值,常以热的形式表现出来。熵变(△S)指的是体系的混乱程度。S(g)>S(l)>S(s)2、自发反应与否的判断依据△H-T△S<0正反应自发反应△H-T△S>0逆反应自发反应【知识网络】【方法整合】类型一:化学反应速率的计算1、化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。计算公式为,单位为mol·L-1·min-1或mol·L-1·s-1。2、同一个化学反应mA(g)+nB(g)pC(g),同一段时间内,用不同物质的浓度变化表示化学反应速率时,数值可能不同,但是意义相同。当用不同物质表示同一化学反应的反应速率时,反应速率之比等于化学方程式中有关物质的化学计量数之比,即v(A):v(B):v(C)=m:n:p。1在2L的密闭容器中,加入1mol和3mol的H2和N2,发生N2+3H22NH3,在2s末时,测得容器中含有0.4mol的NH3,求该反应的化学反应速率。解析:N2+3H22NH3起始量(mol):1302s末量(mol):1-0.23-0.60.4变化量(mol):0.20.60.4则V(N2)==0.2/2×2==0.05mol/(L·s)V(H2)==0.6/2×2==0.1...