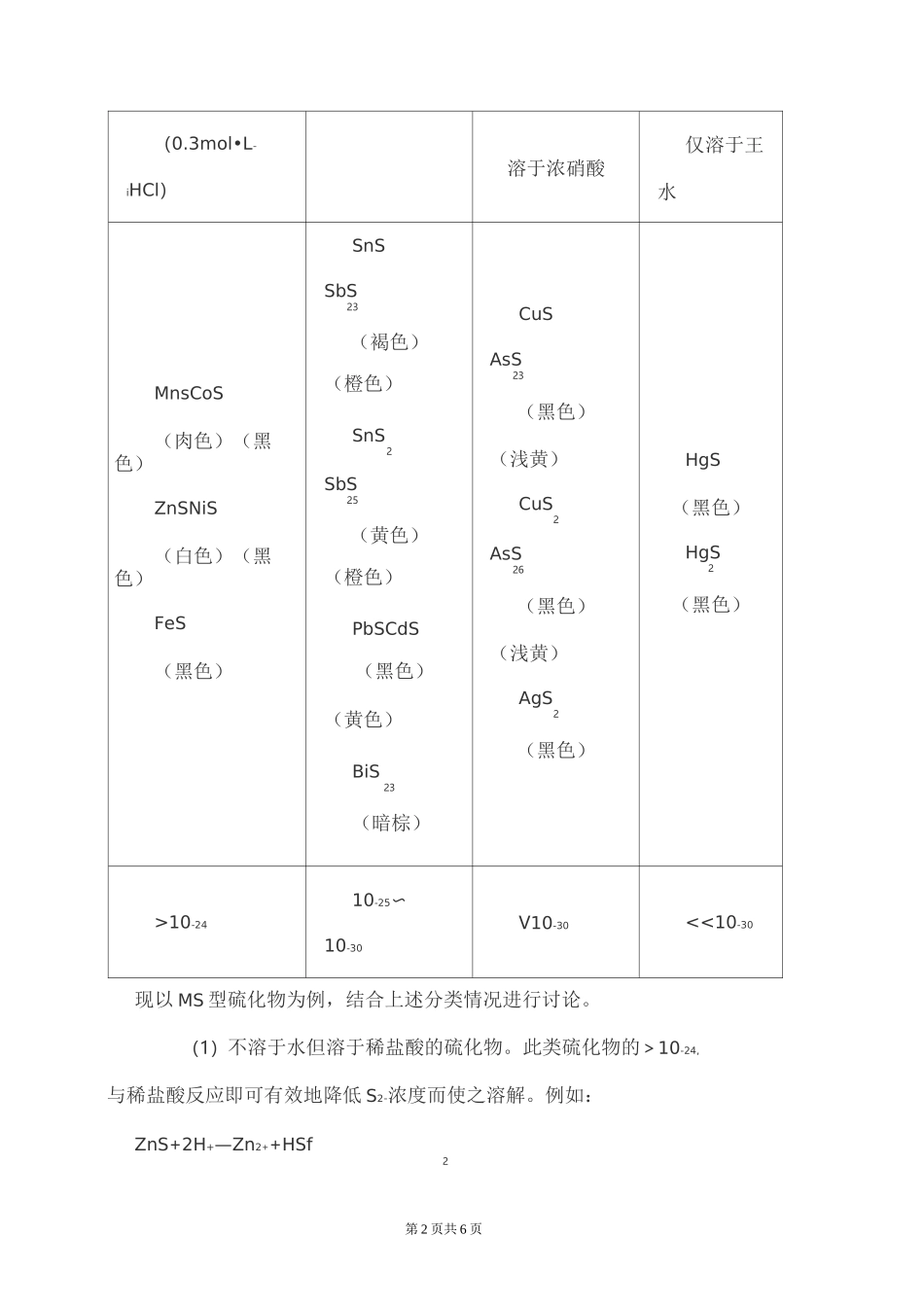
金属硫化物有哪些(1)碱金属硫化物(LiCs)全部易溶于水。(硫化铵在低温下 0度左右易溶于水,但是在常温下会逐渐分解为氨和硫化氢)(2)碱土金属硫化物(除了 Be)(MgBa)易溶于水,但是同时完全水解为氢氧化物和硫氢化物。(3)铝,铍,铬的硫化物全部水解为硫化氢气体和氢氧化物沉淀。(4) FeS,ZnS,MnS,NiS,CoS 不溶于水但溶于稀盐酸。(5) BiS,SnS,SnS,PbS,CdS,BiS 等不溶于水和稀盐酸,只溶23225于浓盐酸。(6) CuS,CuS,Ag2S 不溶于水,稀盐酸,浓盐酸,只溶于浓硝酸。2(7) HgS,HgS 不溶于水,浓稀盐酸,浓硝酸,只溶于王水。2氢硫酸大多数金属硫化物难溶于水。从结构方面来看,S2-的半径比较大,因此变形性较大,在与重金属离子结合时,由于离子相互极化作用,使这形金属硫化物中的 M—S 键显共价性,造成此类硫化物难溶于水。显然,成属离子的极化作用越强,其硫化物溶解度越小。根据硫化物在酸中的正解情况,将其分为四类。皿溶于稀盐禾酸酸难溶于稀盐酸溶于浓盐酸难溶于浓盐酸式盐第 1 页共 6 页,酸第 2 页共 6 页(0.3mol•L-iHCl)溶于浓硝酸仅溶于王水MnsCoS(肉色)(黑色)ZnSNiS(白色)(黑色)FeS(黑色)SnSSbS23(褐色)(橙色)SnS2SbS25(黄色)(橙色)PbSCdS(黑色)(黄色)BiS23(暗棕)CuSAsS23(黑色)(浅黄)CuS2AsS26(黑色)(浅黄)AgS2(黑色)HgS(黑色)HgS2(黑色)>10-2410-25〜10-30V10-30<<10-30现以 MS 型硫化物为例,结合上述分类情况进行讨论。(1)不溶于水但溶于稀盐酸的硫化物。此类硫化物的>10-24,与稀盐酸反应即可有效地降低 S2-浓度而使之溶解。例如:ZnS+2H+—Zn2++HSf2第 3 页共 6 页(2)不溶于水和稀盐酸,但溶于浓盐酸的硫化物。此类硫化物的在10-25〜10—30之间,与浓盐酸作用除产生 HS 气体外,还生成配合物,2降低了金属离子的浓度。例如:PbS+4HC1—H[PbCl]+HSf242(3)不溶于水和盐酸,但溶于浓硝酸的硫化物。此类硫化物的 V10-30,与浓硝酸可发生氧化还原反应,溶液中的 S2-被氧化为 S,S2—浓度大为降低而导致硫化物的溶解。例如:3CuS+8HN0—3Cu(NO)+3S1+2NOf+4HO3322(4)仅溶于王水的硫化物。对于更小的硫化物如 HgS 来说,必须用王水才能溶解。因为王水不仅能使 S2-氧化,还能使 Hg2+与 Cl-结合,从而使硫化物溶解。反应如下:3HgS+2HNO+12HC1—3H[HgCl]+3S1+2N0f+4HO3242由于氢硫酸是弱酸,故硫化物都有不同程度的水解性。碱金属硫化物,例如NaS 溶...