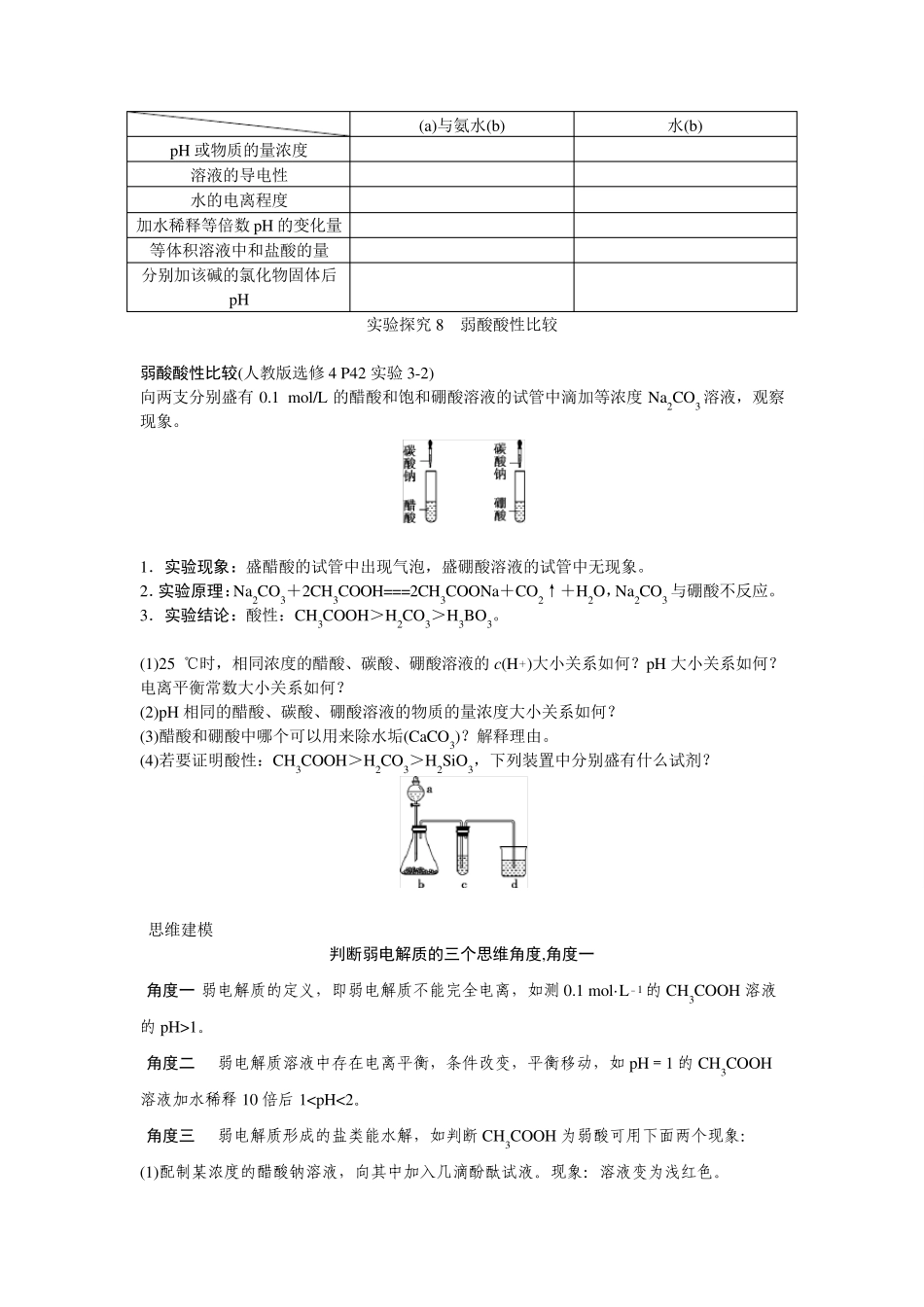
考点三 强、弱电解质的比较与判断 【过程与方法】 [复习提要] 一、强、弱电解质的比较 以一元强酸(HCl)与一元弱酸(CH3COOH)的比较为例。 等物质的量浓度 的盐酸(a)与醋 酸溶液(b) 等 pH 的盐酸(a) 与醋酸溶液(b) pH 或物质的量浓度 pH:ab a=b 水的电离程度 ab a>b 等物质的量浓度 的盐酸(a)与醋 酸溶液(b) 等 pH 的盐酸(a) 与醋酸溶液(b) 等体积溶液中和 NaOH 的量 a=b ab 相同 等体积溶液与过量活泼金属产生 H2 的量 相同 a1,则 HA为 酸 方法 2 跟同浓度的盐酸比较导电性 若导电性和盐酸相同,则为 ;若比盐酸弱,则为 酸 方法 3 跟同浓度的盐酸比较和锌反应的快慢 若反应速率相同,则为 ;若比盐酸慢,则为 2.从是否存在电离平衡的角度判断 (1)从一定 pH 的 HA 溶液稀释前后 pH 的变化判断 如将 pH=3 的 HA 溶液稀释 100 倍后,再测其 pH,若 pH=5,则为 ,若 pH<5,则为 。 (2)从升高温度后 pH 的变化判断 若升高温度,溶液的 pH 明显减小,则是 。因为弱酸存在电离平衡,升高温度时,电离程度增大,c(H+)增大。而强酸不存在电离平衡,升高温度时,只有水的电离程度增大,pH 变化幅度小。 3.从酸根离子是否能发生水解的角度判断 可直接测定 NaA 溶液的 pH:若 pH=7,则 HA 是 ;若 pH>7,则 HA 是 。 [自我检测] 1.(2016·沈阳高三模拟)将c(H+)相同的盐酸和醋酸分别用蒸馏水稀释至原来体积的m 倍和n倍,稀释后两溶液的c(H+)仍相同,则m 和n的关系是( ) A.m>n B.m