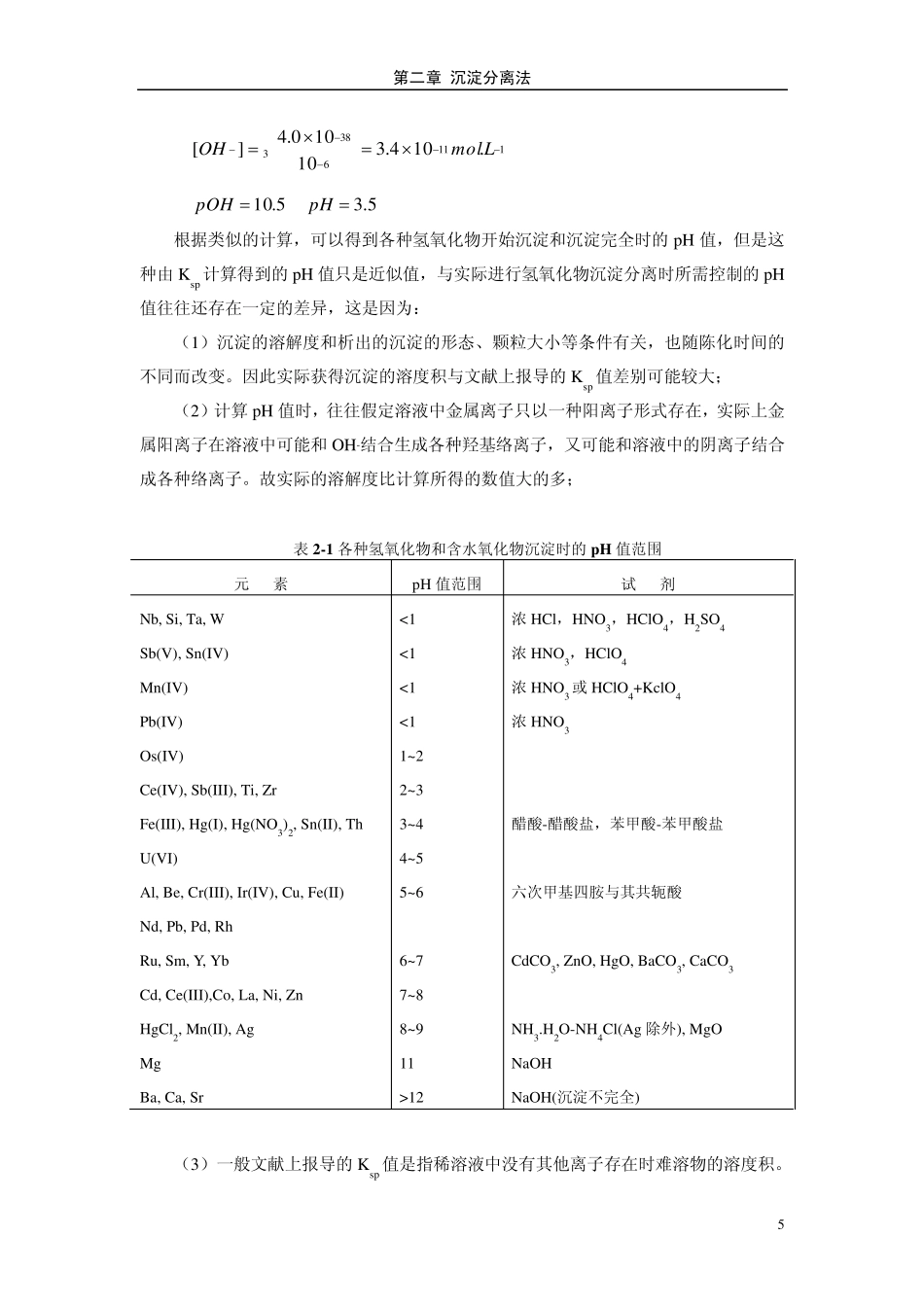
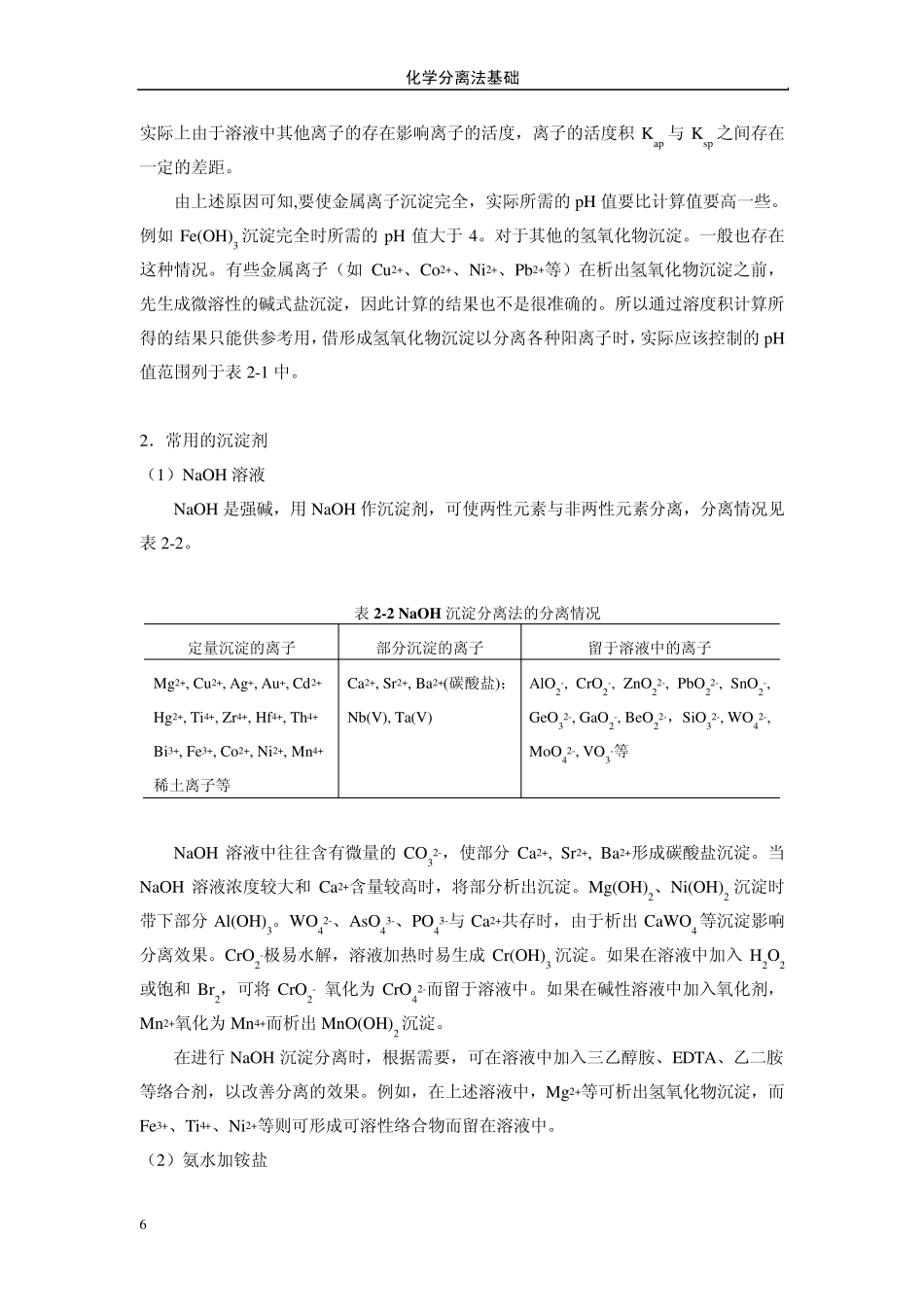
4 第二章 沉淀分离法 沉淀分离(separation by precipitation)法是在试液中加入适当的沉淀剂,使某一成分以一定组成的固相析出,经过滤而与液相相分离的方法。沉淀分离法是一种经典的化学分离方法,该法需经过过滤、洗涤等步骤,操作较为烦琐费时,但通过改进分离操作,使用选择性较好的沉淀剂,可以加快分离速度,提高分离效率,因此至今仍得到广泛的应用。 本章主要介绍无机沉淀剂分离法、有机沉淀剂分离法、均相沉淀分离法和共沉淀分离法四类方法。 §2-1 无机沉淀剂分离法 一些离子的氢氧化物、硫化物、硫酸盐、碳酸盐、草酸盐、磷酸盐、铬酸盐和卤化物等具有较小的溶解度,借此可以进行沉淀分离。另外还有一些离子可以被还原为金属单质而被沉淀分离开。 一、沉淀为氢氧化物 1.氢氧化物沉淀与溶液 pH 值的关系 可以形成氢氧化物沉淀的离子种类很多,根据各种氢氧化物的溶度积,可以大致计算出各种金属离子开始析出沉淀时的 pH 值。例如Fe(OH)3 的 Ksp=4×10-38,若[Fe3+]=0.010mol.L-1,欲使 Fe(OH)3 析出沉淀,则必须满足以下条件: 383104]][[OHFe 010.0104][383OH 112.106.1][LmolOH 8.11pOH 2.2pH 由此可见,欲使 0.010mol.L-1 Fe3+析出 Fe(OH)3 沉淀溶液的 pH 值应大于 2.2。当溶液中残留的 Fe3+的浓度为 10-6 mol.L-1 时,即 99.99%的 Fe3+已被沉淀,可以认为沉淀已经完全,此时的 pH 值为: 第二章 沉淀分离法 5 1113638.104.310100.4][LmolOH 5.10pOH 5.3pH 根据类似的计算,可以得到各种氢氧化物开始沉淀和沉淀完全时的pH 值,但是这种由Ksp 计算得到的pH 值只是近似值,与实际进行氢氧化物沉淀分离时所需控制的pH值往往还存在一定的差异,这是因为: (1)沉淀的溶解度和析出的沉淀的形态、颗粒大小等条件有关,也随陈化时间的不同而改变。因此实际获得沉淀的溶度积与文献上报导的Ksp 值差别可能较大; (2)计算pH 值时,往往假定溶液中金属离子只以一种阳离子形式存在,实际上金属阳离子在溶液中可能和OH-结合生成各种羟基络离子,又可能和溶液中的阴离子结合成各种络离子。故实际的溶解度比计算所得的数值大的多; 表 2-1 各种氢氧化物和含水氧化物沉淀时的pH 值范围 元 素 pH 值范围 试 剂 Nb, Si, Ta, W Sb(V), Sn(IV) Mn(IV) Pb(IV) Os(IV) Ce(IV), Sb(III), Ti, Zr Fe(III), Hg(I), ...