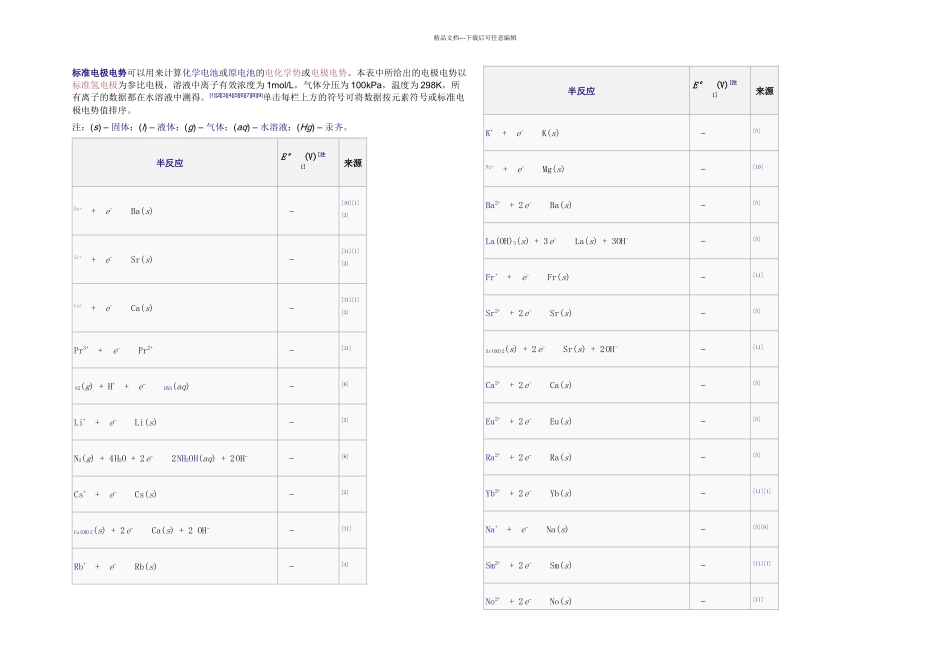
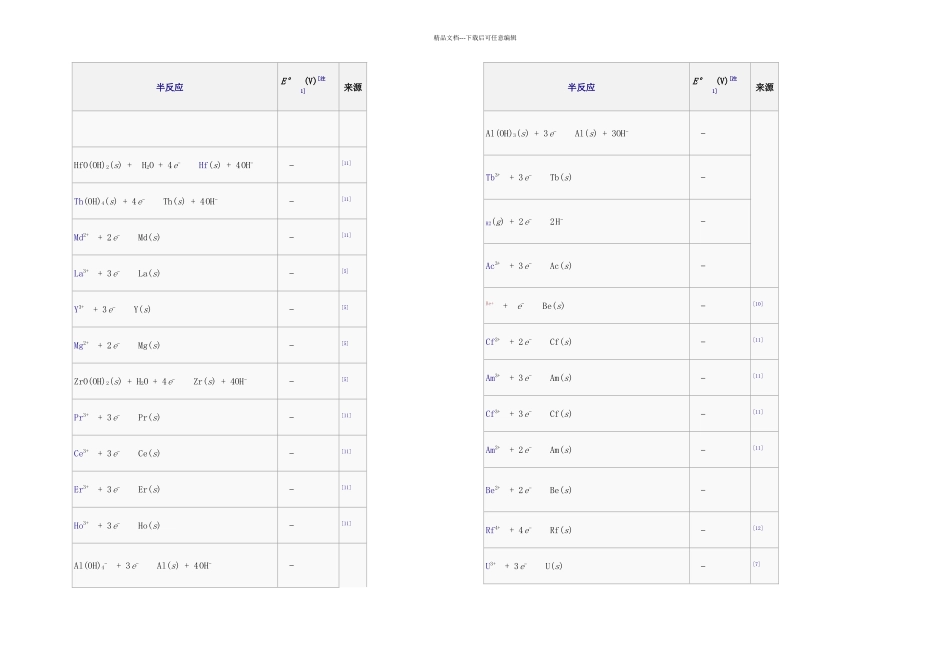
精品文档---下载后可任意编辑标准电极电势可以用来计算化学电池或原电池的电化学势或电极电势。本表中所给出的电极电势以标准氢电极为参比电极,溶液中离子有效浓度为 1mol/L,气体分压为 100kPa,温度为 298K,所有离子的数据都在水溶液中测得。[1][2][3][4][5][6][7][8][9]单击每栏上方的符号可将数据按元素符号或标准电极电势值排序。注:(s) – 固体;(l) – 液体;(g) – 气体;(aq) – 水溶液;(Hg) – 汞齐。半反应E° (V)[注 1]来源Ba+ + e− Ba(s) −[10][1][3]Sr+ + e− Sr(s) −[11][1][3]Ca+ + e− Ca(s) −[11][1][3]Pr3+ + e− Pr2+ −[11] N2(g) + H+ + e− HN3(aq) −[6]Li+ + e− Li(s) −[5]N2(g) + 4 H2O + 2 e− 2 NH2OH(aq) + 2 OH− −[6]Cs+ + e− Cs(s) −[5]Ca(OH)2(s) + 2 e− Ca(s) + 2 OH− −[11]Rb+ + e− Rb(s) −[4]半反应E° (V)[注 1]来源K+ + e− K(s) −[5]Mg+ + e− Mg(s) −[10]Ba2+ + 2 e− Ba(s) −[5]La(OH)3(s) + 3 e− La(s) + 3OH− −[5]Fr+ + e− Fr(s) −[11]Sr2+ + 2 e− Sr(s) −[5]Sr(OH)2(s) + 2 e− Sr(s) + 2 OH− −[11]Ca2+ + 2 e− Ca(s) −[5]Eu2+ + 2 e− Eu(s) −[5]Ra2+ + 2 e− Ra(s) −[5]Yb2+ + 2 e− Yb(s) −[11][1]Na+ + e− Na(s) −[5][9]Sm2+ + 2 e− Sm(s) −[11][1]No2+ + 2 e− No(s) −[11]精品文档---下载后可任意编辑半反应E° (V)[注 1]来源HfO(OH)2(s) + H2O + 4 e− Hf(s) + 4 OH− −[11]Th(OH)4(s) + 4 e− Th(s) + 4 OH− −[11]Md2+ + 2 e− Md(s) −[11]La3+ + 3 e− La(s) −[5]Y3+ + 3 e− Y(s) −[5]Mg2+ + 2 e− Mg(s) −[5]ZrO(OH)2(s) + H2O + 4 e− Zr(s) + 4OH− −[5]Pr3+ + 3 e− Pr(s) −[11]Ce3+ + 3 e− Ce(s) −[11]Er3+ + 3 e− Er(s) −[11]Ho3+ + 3 e− Ho(s) −[11]Al(OH)4− + 3 e− Al(s) + 4 OH− −半反应E° (V)[注 1]来源Al(OH)3(s) + 3 e− Al(s) + 3OH− −Tb3+ + 3 e− Tb(s) −H2(g) + 2 e− 2 H− −Ac3+ + 3 e− Ac(s) −Be+ + e− Be(s) −[10]Cf2+ + 2 e− Cf(s) −[11]Am3+ + 3 e− Am(s) −[11]Cf3+ + 3 e− Cf(s) −[11]Am2+ + 2 e−...