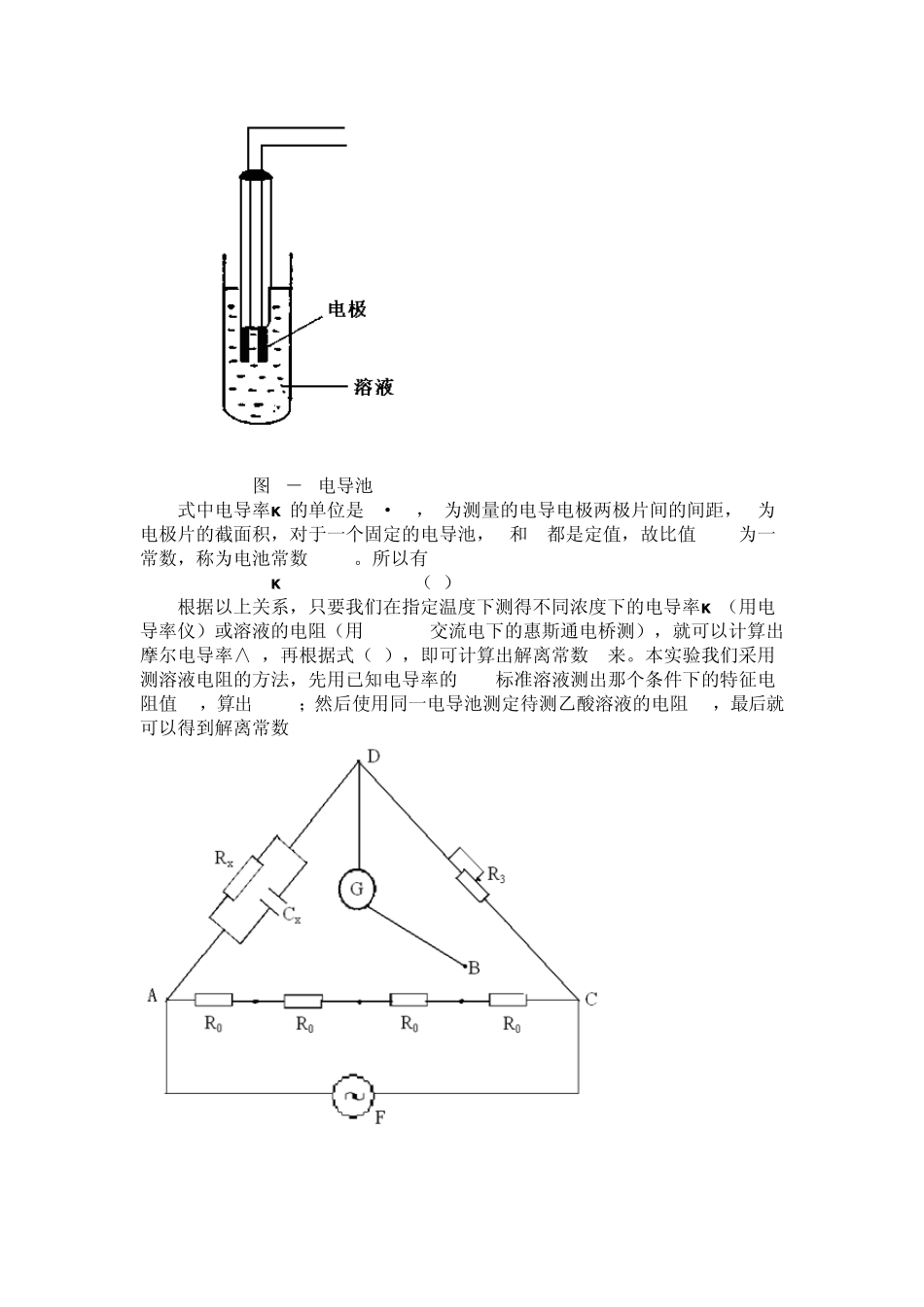
实验九 电导法测定乙酸解离常数 一、实验目的 1. 学会用电导法测定一元弱酸的解离常数; 2. 熟悉电导池、电导池常数、溶液电导(或电导率)等相关基本概念; 3. 掌握电桥法测量溶液电导的实验方法和技术。 二、实验原理 根据 Arrhenius(阿累尼乌斯)的电离理论,弱电解质与强电解质不同,它在溶液中仅部分解离,离子和未解离的分子之间存在着动态平衡。如乙酸水溶液中,设 c为乙酸的原始浓度,α c为解离度,其解离平衡为: 电离刚开始时: c 0 0 电离平衡时: c(1-α c) cα c cα c 设其解离常数为 K,则 К =cαc2/(1-α c)(1) 由电化学理论可知,浓度为 c的弱电解质稀溶液的解离度α c 应等于该浓度下的摩尔电导率∧m和溶液在无限稀时的摩尔电导率К 之比, 即 α c=∧m/∧∞m(2) 将(2)代入(1)式得: (3) 在上式中,c为已知,∧m通过本实验求得,∧∞m尽管随温度的变化而变化,但仍然可以应用离子独立运动定律计算得到。 (4) 在 298.15K时,∧∞m(HAc)是390.71X10-4S²m2²mol-1。任意温度下, ∧∞m,t(H+)=λ ∞m,25°C(H+)[1+0.014(t-25)] =349.82³10-4³[1+0.014(t-25)]S²m2²mol-1 ∧∞m,t(H+)=λ ∞m,25°C(AC-)[1+0.02(t-25)] =40.9³10-4³[1+0.02(t-25)]S²m2²mol-1 如何求得指定温度和浓度下的摩尔电导率∧m呢?我们通过测盛有稀溶液的电导池里的电导 G或电导率К 的方法来解决。 G=1/R=A/ρ ²l=κ ²A/l;当浓度 c的单位用 mol²L-1表示而摩尔电导率∧m的单位用 S²m2²mol-1表示时,∧m=0.001κ /c(5) 图6-1电导池 式中电导率κ 的单位是S²m-1, 为测量的电导电极两极片间的间距,A为电极片的截面积,对于一个固定的电导池,l和A都是定值,故比值 l/A为一常数,称为电池常数Kcell。所以有 κ =Kcell/R (6) 根据以上关系,只要我们在指定温度下测得不同浓度下的电导率κ (用电导率仪)或溶液的电阻(用1000Hz交流电下的惠斯通电桥测),就可以计算出摩尔电导率∧m,再根据式(3),即可计算出解离常数K来。本实验我们采用测溶液电阻的方法,先用已知电导率的KCl标准溶液测出那个条件下的特征电阻值RS,算出Kcell;然后使用同一电导池测定待测乙酸溶液的电阻Rx,最后就可以得到解离常数K 图 6-2惠茨通电桥示意图 R0为某一固定值的电阻,有四个;R3为电阻箱;Rx为待测电阻(即电导池溶液的);G为电桥平衡检测...