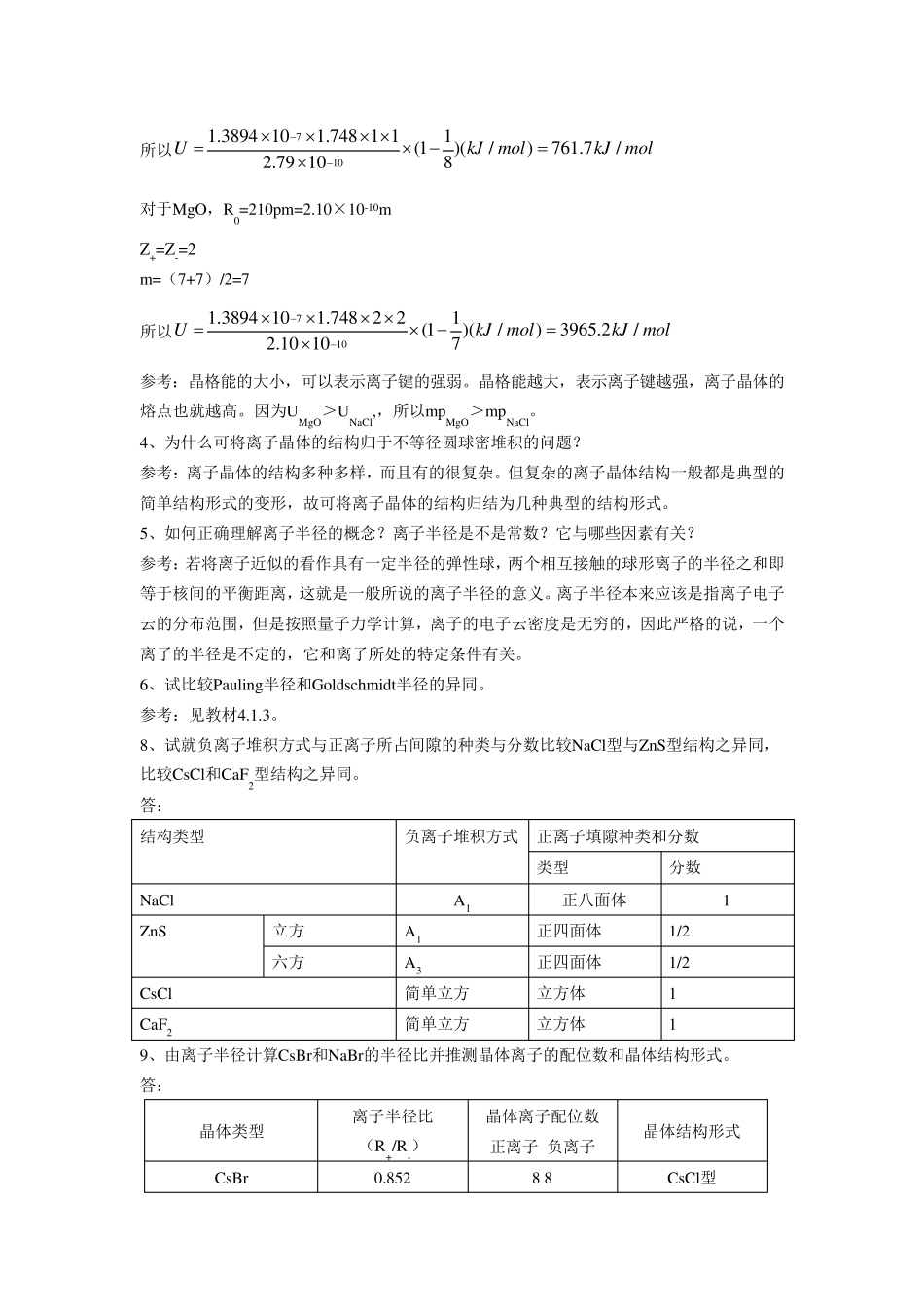
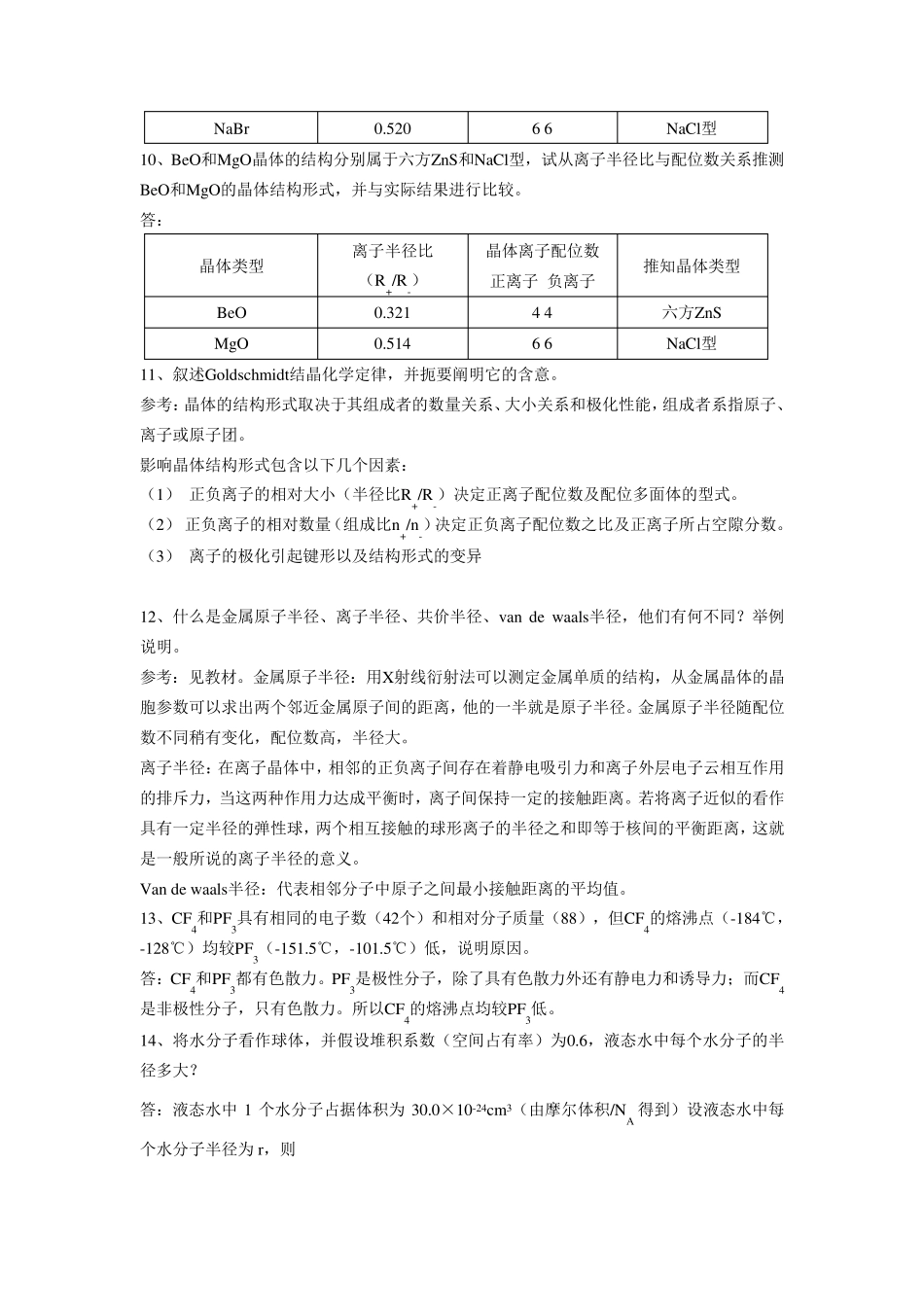
第四章 1、试用热化学求KCl晶体的点阵能,所需要的数据如下表所示。 物理量 ΔH生成 ΔH升华 IK ΔH分解 YCl 数值/kJ·mol-1 -435 84 418 243 -368 解:根据Hess定律 2、已知KCl晶体具有NaCl型结构,晶胞棱长628pm。试计算KCl晶体的点阵能,并与上题所求的结果比较。 解:根据201(1)4AAN Z Z eURm 将NA、e、ε0等按国际单位所给数值代入,得 701.3894 101(1)(/)UAZ ZkJ molRm KCl具有NaCl晶型,即A=1.748,又Z+=Z—=1,1 (99)2m =9 10016283143.14 102Rpmpmm 所以7101.3894 101.748 1 11(1)(/)687.5/3.14 109UkJmolkJmol 3、从理论计算公式计算NaCl与MgOde晶格能。MgO的熔点为2800℃,NaCl为801℃,请说明这种差别的原因。 解:NaCl、MgO同属于NaCl型结构,根据201(1)4AAN Z Z eURm 将NA、e、ε0等按国际单位所给数值代入 701.3894 101.7481(1)(/)UZ ZkJ molRm 对于NaCl,R0=279pm=2.79×10-10m Z+=Z-=1 m=(7+9)/2=8 所以7101.3894 101.748 1 11(1)(/)761.7/2.79 108UkJmolkJmol 对于MgO,R0=210pm=2.10×10-10m Z+=Z-=2 m=(7+7)/2=7 所以7101.3894 101.7482 21(1)(/)3965.2/2.10 107UkJmolkJmol 参考:晶格能的大小,可以表示离子键的强弱。晶格能越大,表示离子键越强,离子晶体的熔点也就越高。因为UMgO>UNaCl,,所以mpMgO>mpNaCl。 4、为什么可将离子晶体的结构归于不等径圆球密堆积的问题? 参考:离子晶体的结构多种多样,而且有的很复杂。但复杂的离子晶体结构一般都是典型的简单结构形式的变形,故可将离子晶体的结构归结为几种典型的结构形式。 5、如何正确理解离子半径的概念?离子半径是不是常数?它与哪些因素有关? 参考:若将离子近似的看作具有一定半径的弹性球,两个相互接触的球形离子的半径之和即等于核间的平衡距离,这就是一般所说的离子半径的意义。离子半径本来应该是指离子电子云的分布范围,但是按照量子力学计算,离子的电子云密度是无穷的,因此严格的说,一个离子的半径是不定的,它和离子所处的特定条件有关。 6、试比较Pau ling半径和Goldschmidt半径的异同。 参考:见教材4.1.3。 8、试就负离子堆积方式与正离子所占间隙的种类与分数比较NaCl型与ZnS型结构之异同,比较CsCl和CaF2型结构之...