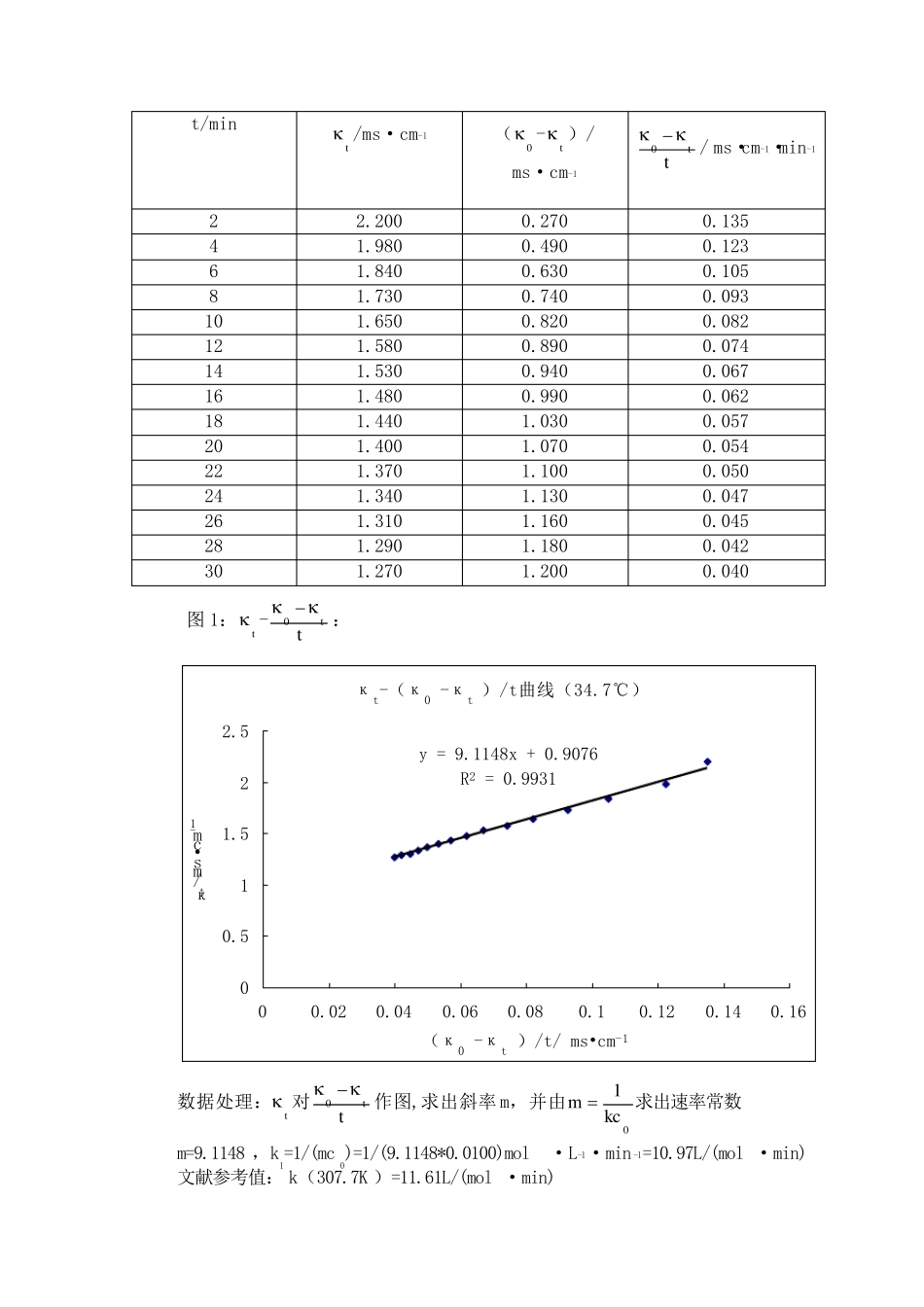
电导法测定乙酸乙酯皂化反应的速率常数 【实验目的】 1、学习电导法测定乙酸乙酯皂化反应速率常数的原理和方法以及活化能的测定方法; 2、了解二级反应的特点,学会用图解计算法求二级反应的速率常数; 3、熟悉电导仪的使用。 【实验原理】 1、速率常数的测定 乙酸乙酯皂化反应时典型的二级反应,其反应式为: CH3COOC2H5+NaOH = CH3OONa+C2H5OH t=0 C0 C0 0 0 t=t Ct Ct C0 - Ct C0 -Ct t=∞ 0 0 C0 C0 速率方程式 2kcdtdc ,积分并整理得速率常数k 的表达式为: t0t0cccct1k 假定此反应在稀溶液中进行,且CH3COONa 全部电离。则参加导电离子有Na+、OH-、CH3COO-,而Na+反应前后不变,OH-的迁移率远远大于CH3COO-,随着反应的进行, OH- 不断减小,CH3COO-不断增加,所以体系的电导率不断下降,且体系电导率(κ) 的下降和产物 CH3COO-的浓度成正比。 令0 、t 和 分别为0、t 和∞时刻的电导率,则: t=t 时,C0 –Ct=K(0 -t ) K 为比例常数 t→∞时,C0= K(0 - ) 联立以上式子,整理得: tkc1t00t 可见,即已知起始浓度 C0,在恒温条件下,测得0 和t ,并以t 对tt0 作图,可得一直线,则直线斜率0kc1m ,从而求得此温度下的反应速率常数k。 2、活化能的测定原理: )11(kkln21a12TTRE 因 此 只 要 测 出 两 个 不 同 温 度 对 应 的 速 率 常 数 , 就 可 以 算 出 反 应 的 表 观 活 化 能 。 【 仪 器 与 试 剂 】 电 导 率 仪 1 台 铂 黑 电 极 1 支 大 试 管 5 支 恒 温 槽 1 台 移 液 管 3 支 氢 氧 化 钠 溶 液 ( 1.985× 10-2mol/L) 乙 酸 乙 酯 溶 液 ( 1.985× 10-2mol/L) 【 实 验 步 骤 】 1、 调 节 恒 温 槽 的 温 度 在 34.70℃ ; 2、 在 1-3 号 大 试 管 中 , 依 次 倒 入 约 20mL 蒸 馏 水 、 35mL 1.985× 10-2mol/L 的 氢 氧化 钠 溶 液 和 25mL1.985× 10-2mol/L 乙 酸 乙 酯 溶 液 , 塞 紧 试 管 口 , 并 置 于 恒 温 槽 中 恒 温 。 3、 安 装 调 节 好 电 导 率 仪 ; 4、0 的 测 定 : 从 1 号 和 2 号 试 管 中 ,分 别 准 确 移 取 10mL 蒸 馏 ...