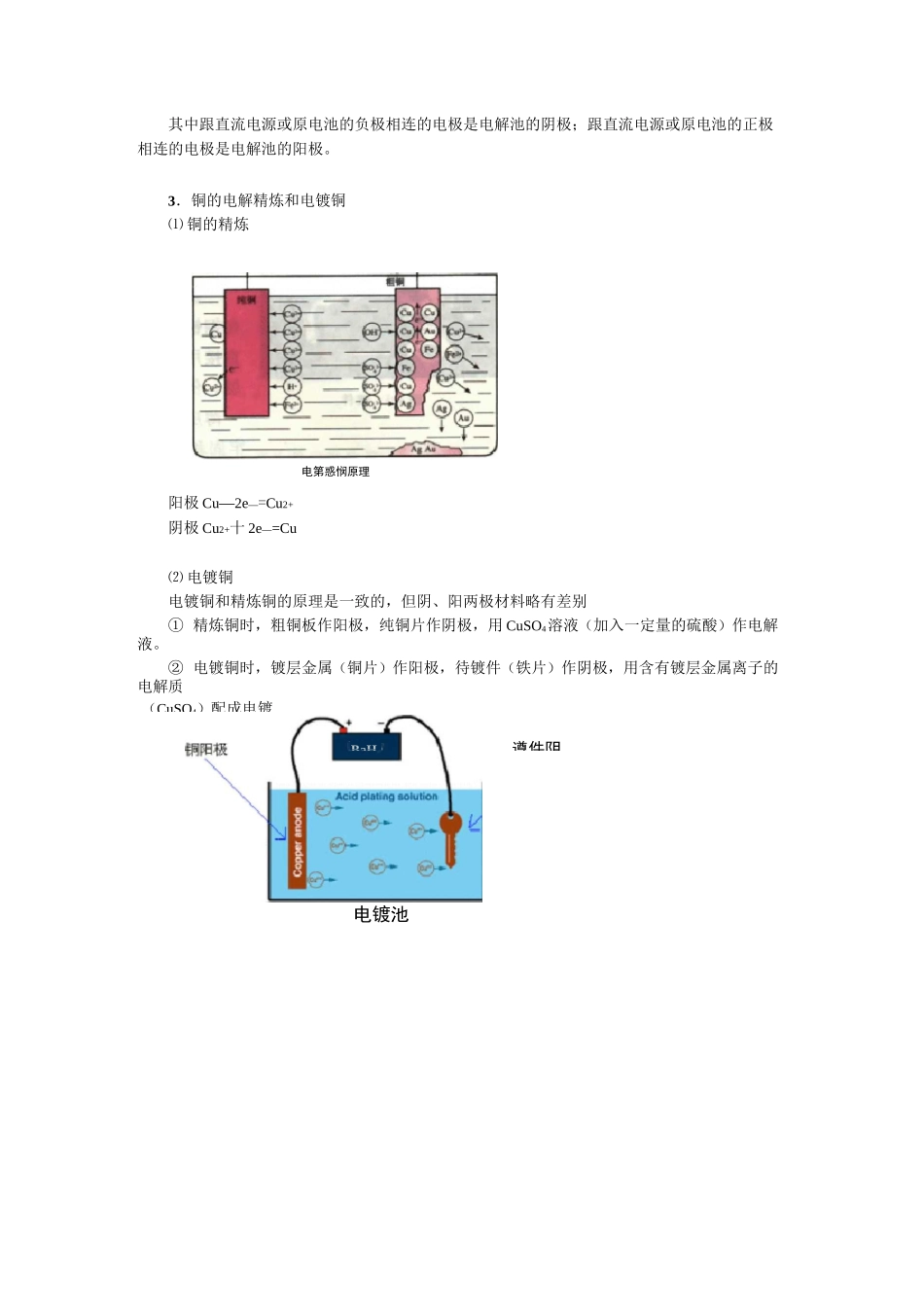
e—q电罅池与直谎电源的连槿阴概发生还匣编稿:顾振海审稿:潘廷宏责编:顾振海[重点难点]1.理解电解的基本概念和原理。2.了解铜的电解精炼、电镀铜。3.会写电极反应式、电解方程式,掌握围绕电解的计算。[知识点讲解][基础知识导引]i.电解_—使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。如用惰性电极电解 CuCl2溶液时,电极反应式:阳极 2C1——2e—=Cl2f(氧化反应)阴极 Cu2++2e—=Cu(还原反应)电解方程式为:CuCIz—CufCht2.电解池把电能转变为化学能的装置叫做电解池或电解槽。遵件阴其中跟直流电源或原电池的负极相连的电极是电解池的阴极;跟直流电源或原电池的正极相连的电极是电解池的阳极。3.铜的电解精炼和电镀铜⑴ 铜的精炼电第惑悯原理阳极 Cu—2e—=Cu2+阴极 Cu2+十 2e—=Cu⑵ 电镀铜电镀铜和精炼铜的原理是一致的,但阴、阳两极材料略有差别① 精炼铜时,粗铜板作阳极,纯铜片作阴极,用 CuSO4溶液(加入一定量的硫酸)作电解液。② 电镀铜时,镀层金属(铜片)作阳极,待镀件(铁片)作阴极,用含有镀层金属离子的电解质电镀池(CuSO4)配成电镀BaH■-阴榊—d 阳槿18 粗加后陪猗戛 K[重点难点点拨]一、电解原理1.电解质溶液的导电我们知道,金属导电时,是金属内部的自由电子发生的定向移动,而电解质溶液的导电与金属导电不同。通电前电解质溶液中阴、阳离子在溶液中自由地移动;通电后在电场的作用下,这些自由移动的离子改作定向移动,带负电荷的阴离子由于静电作用向阳极移动,带正电荷的阳离子则向阴极移动,并在两极上发生氧化还原反应。我们把:借助于电流引起氧化还原反应的装置,也就是把电能转化为化学能的装置叫电解池。电解池中与直流电源负极相连的电极叫阴极,与直流电源正极相连的电极叫阳极。物质能否导电是由其内部能否形成定向移动的自由电荷所决定的,对金属就是自由电子,而对电解质溶液就是自由移动的阴阳离子。2.电解(1)概念:使电流流过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫电解。(2)电子流动的方向:电子从外接直流电源的负极流出,经导线到达电解池的阴极,电解池溶液中的阳离子移向阴极,并在阴极获得电子而被还原,发生还原反应;与此同时,电解池溶液中的阴离子移向阳极,并在阳极上失去电子(也可能是阳极很活泼而本身失去电子)而被氧化,发生氧化反应。这样,电子又从电解池的阳极流出,沿导线而流回外接直流电源的正极。...