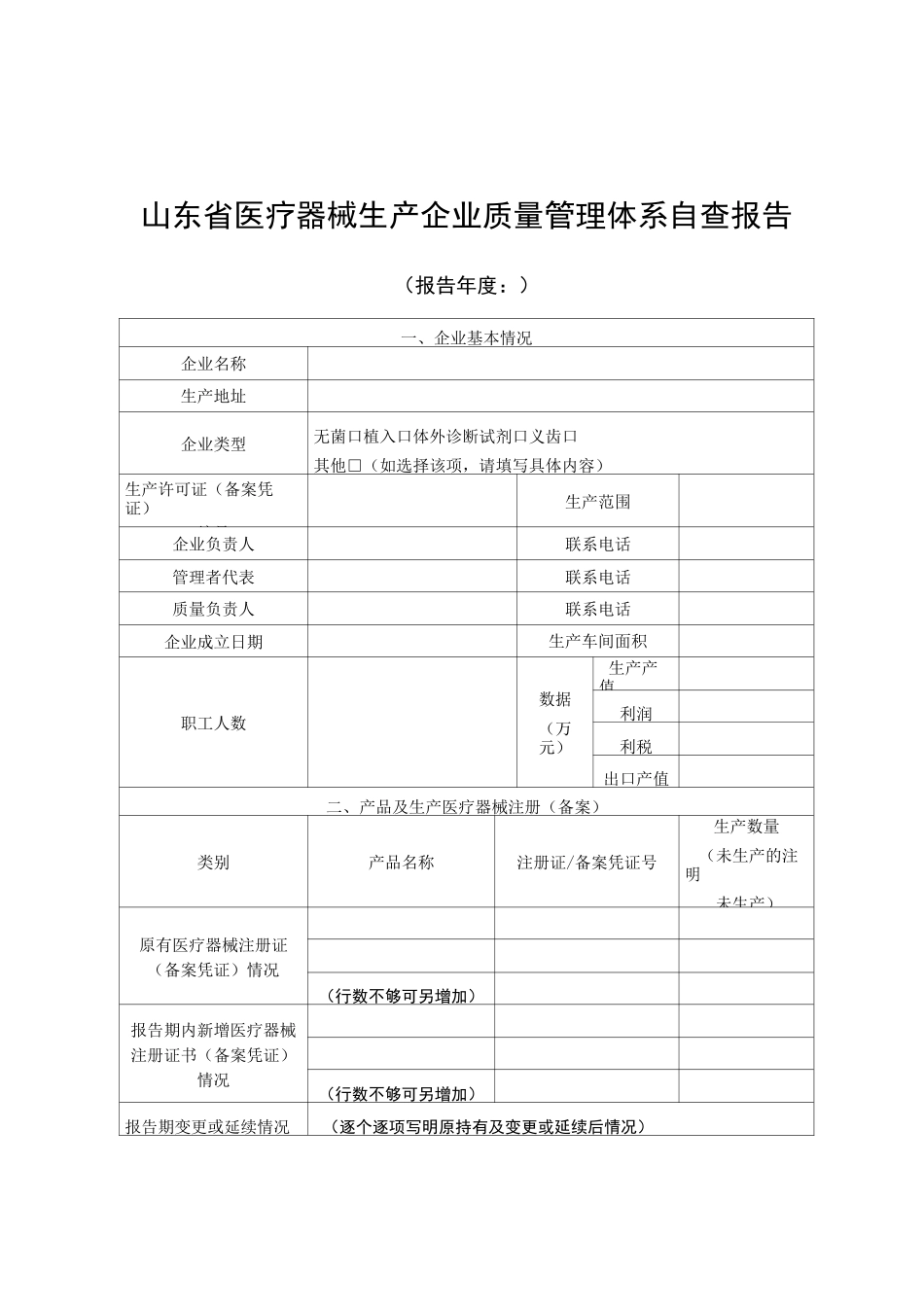
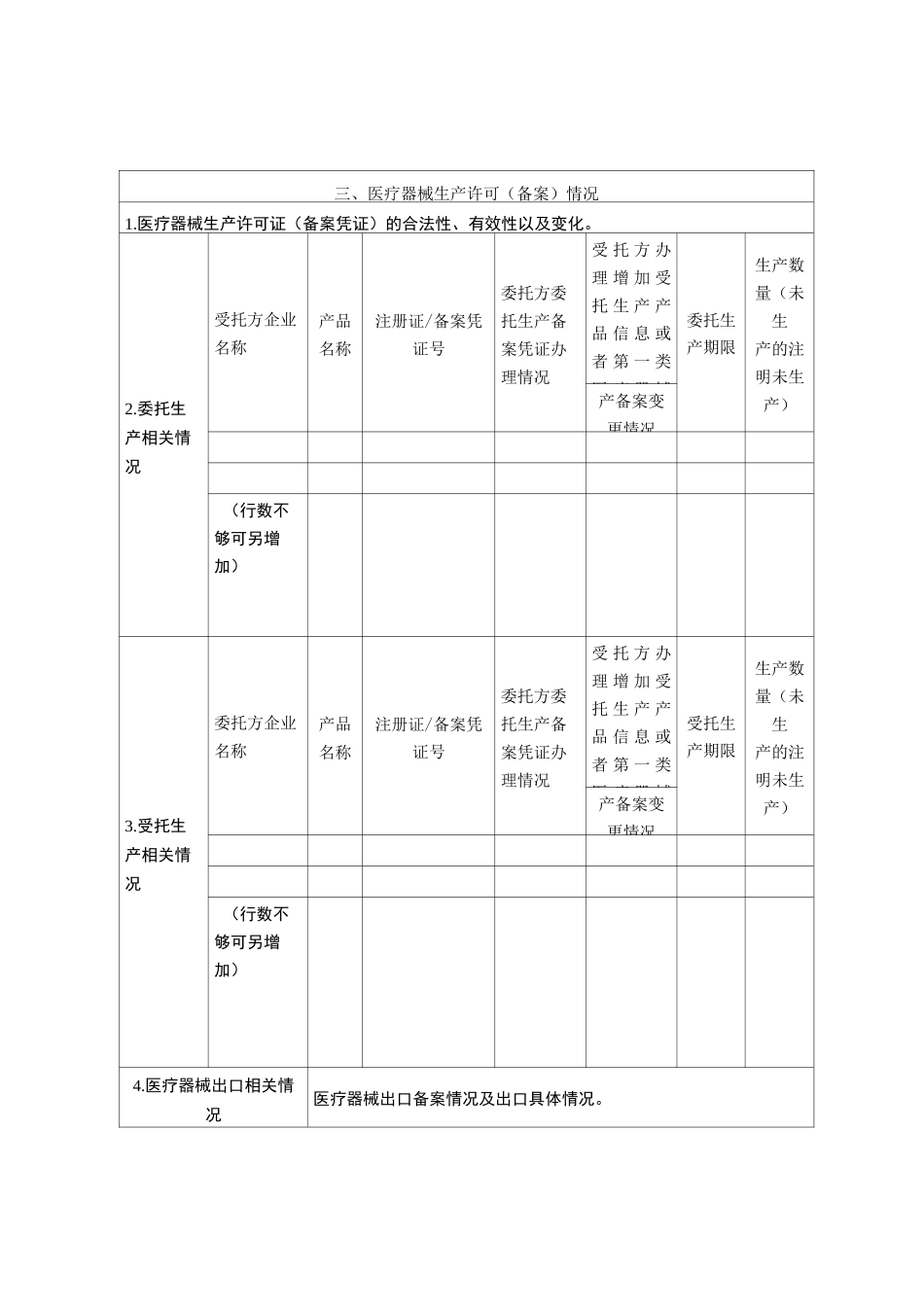
山东省医疗器械生产企业质量管理体系自查报告(报告年度:)一、企业基本情况企业名称生产地址企业类型无菌口植入口体外诊断试剂口义齿口其他□(如选择该项,请填写具体内容)生产许可证(备案凭证)编号生产范围企业负责人联系电话管理者代表联系电话质量负责人联系电话企业成立日期生产车间面积职工人数数据(万元)生产产值利润利税出口产值二、产品及生产医疗器械注册(备案)类别产品名称注册证/备案凭证号生产数量(未生产的注明未生产)原有医疗器械注册证(备案凭证)情况(行数不够可另增加)报告期内新增医疗器械注册证书(备案凭证)情况(行数不够可另增加)报告期变更或延续情况(逐个逐项写明原持有及变更或延续后情况)三、医疗器械生产许可(备案)情况1.医疗器械生产许可证(备案凭证)的合法性、有效性以及变化。2.委托生产相关情况受托方企业名称产品名称注册证/备案凭证号委托方委托生产备案凭证办理情况受 托 方 办理 增 加 受托 生 产 产品 信 息 或者 第 一 类医 疗 器 械委托生产期限生产数量(未生产的注明未生产)产备案变更情况(行数不够可另增加)3.受托生产相关情况委托方企业名称产品名称注册证/备案凭证号委托方委托生产备案凭证办理情况受 托 方 办理 增 加 受托 生 产 产品 信 息 或者 第 一 类医 疗 器 械受托生产期限生产数量(未生产的注明未生产)产备案变更情况(行数不够可另增加)4.医疗器械出口相关情况医疗器械出口备案情况及出口具体情况。新、维护保养、检定校准情况;二是关键生产设施设备、生产条件的验证情况。三是生产、检验等过程记录的归档整理情况。四是委托生产行为情况及实施管理的描述,包括委托生产的产品名称、产品批次、控制方式、质量状况和委托检验的管理(如有)等方面。3.产品设计变更情况:对于与产品安全、性能、预期使用有关的产品设计变更,应对设计的更改、评审、验证及确认进行描述,包括对设计变更后产品是否符合相关法规要求的说明,如产品设计变更后需履行注册手续,应说明相关注册情况。是否采取了相应的风险管理措施及内容。4.采购、销售和售后服务管理情况:包括依据《医疗器械生产企业供应商审核指南》开展供应商审核、评价情况;销售、售后服务工作开展情况、顾客投诉的处置以及产品召回(如有)等工作情况。5.不合格品控制情况:对发生的质量事故、产品抽验发现不合格、出厂检验发现不合格以及生产过程中产生不合格品采取措施...