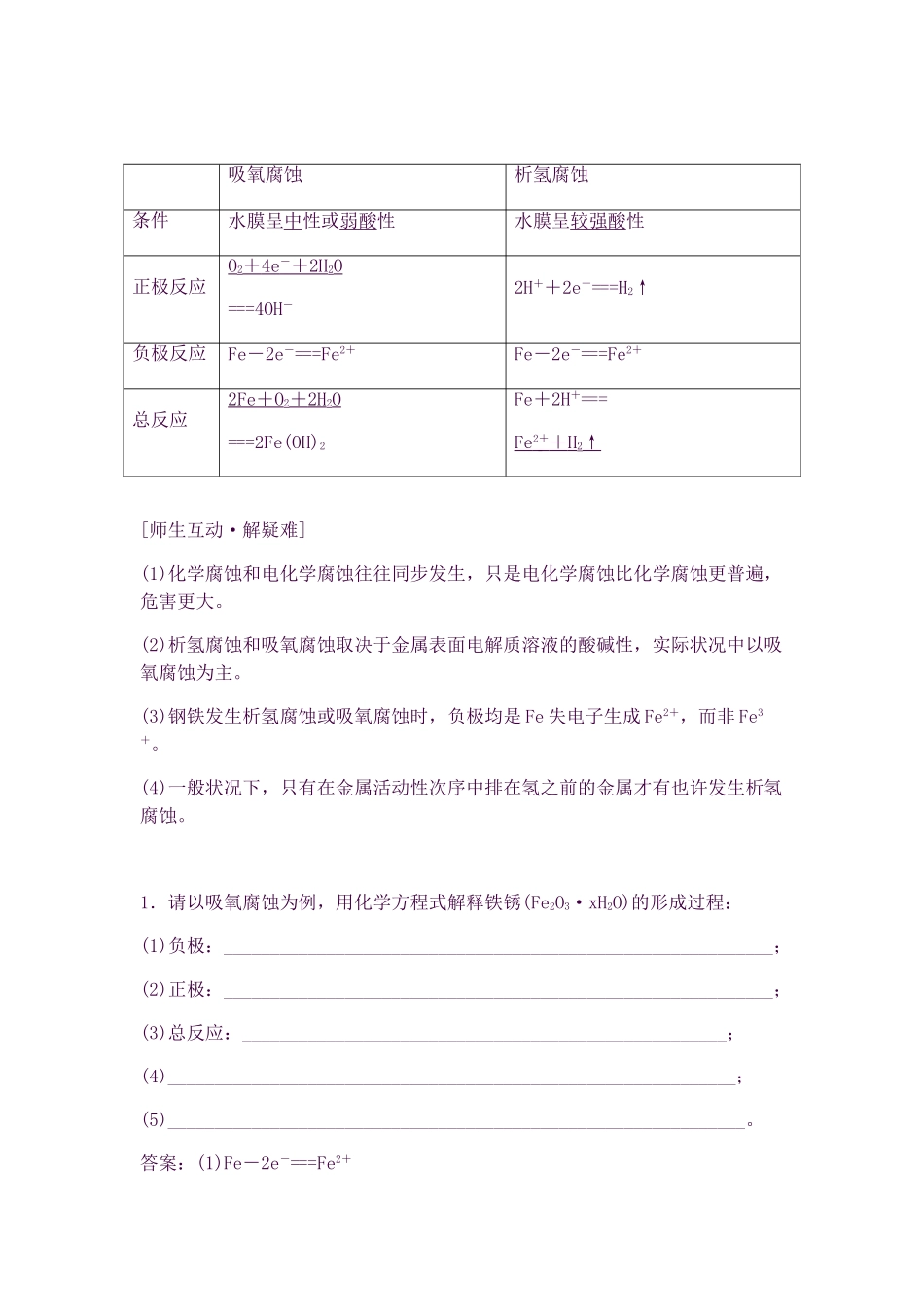
高中化学 第四章 电化学基础 第四节《金属的电化学腐蚀与防护》知识点总结及典例解析 新人教版选修 41.钢铁在酸性环境中重要发生析氢腐蚀,放出氢气。2.钢铁在中性或弱酸性环境中重要发生吸氧腐蚀,最终身成铁锈的重要成分是Fe2O3·nH2O。3.钢铁吸氧腐蚀的正极发生的电极反应是:2H2O+O2+4e-===4OH-。4.金属电化学防护的措施有牺牲阳极的阴极保护法和外加电流的阴极保护法。金属的电化学腐蚀[自学教材·填要点]1.金属的腐蚀(1)概念:金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。(2)本质:金属原子失去电子变为阳离子,金属发生氧化反应。(3)分类:① 化学腐蚀:金属跟接触到的物质直接发生化学反应而引起的腐蚀。② 电化学腐蚀:不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失电子而被氧化。2.钢铁的析氢腐蚀和吸氧腐蚀吸氧腐蚀析氢腐蚀条件水膜呈中性或弱酸性水膜呈较强酸性正极反应O2+ 4e - + 2H 2O===4OH-2H++2e-===H2↑负极反应Fe-2e-===Fe2+Fe-2e-===Fe2+总反应2Fe + O 2+ 2H 2O===2Fe(OH)2Fe+2H+===Fe 2 + + H 2↑[师生互动·解疑难](1)化学腐蚀和电化学腐蚀往往同步发生,只是电化学腐蚀比化学腐蚀更普遍,危害更大。(2)析氢腐蚀和吸氧腐蚀取决于金属表面电解质溶液的酸碱性,实际状况中以吸氧腐蚀为主。(3)钢铁发生析氢腐蚀或吸氧腐蚀时,负极均是 Fe 失电子生成 Fe2+,而非 Fe3+。(4)一般状况下,只有在金属活动性次序中排在氢之前的金属才有也许发生析氢腐蚀。1.请以吸氧腐蚀为例,用化学方程式解释铁锈(Fe2O3·xH2O)的形成过程:(1)负极:___________________________________________________________;(2)正极:___________________________________________________________;(3)总反应:____________________________________________________;(4)_____________________________________________________________;(5)______________________________________________________________。答案:(1)Fe-2e-===Fe2+(2)O2+4e-+2H2O===4OH-(3)2Fe+O2+2H2O===2Fe(OH)2(4)4Fe(OH)2+O2+2H2O===4Fe(OH)3(5)2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O金属的电化学防护[自学教材·填要点]1.金属的防护2.金属的电化学防护(1)牺牲阳极的阴极保护法:应用原电池原理,让被保护金属作正极,另找一种活泼性较强的金属作负极。(2)外加电...