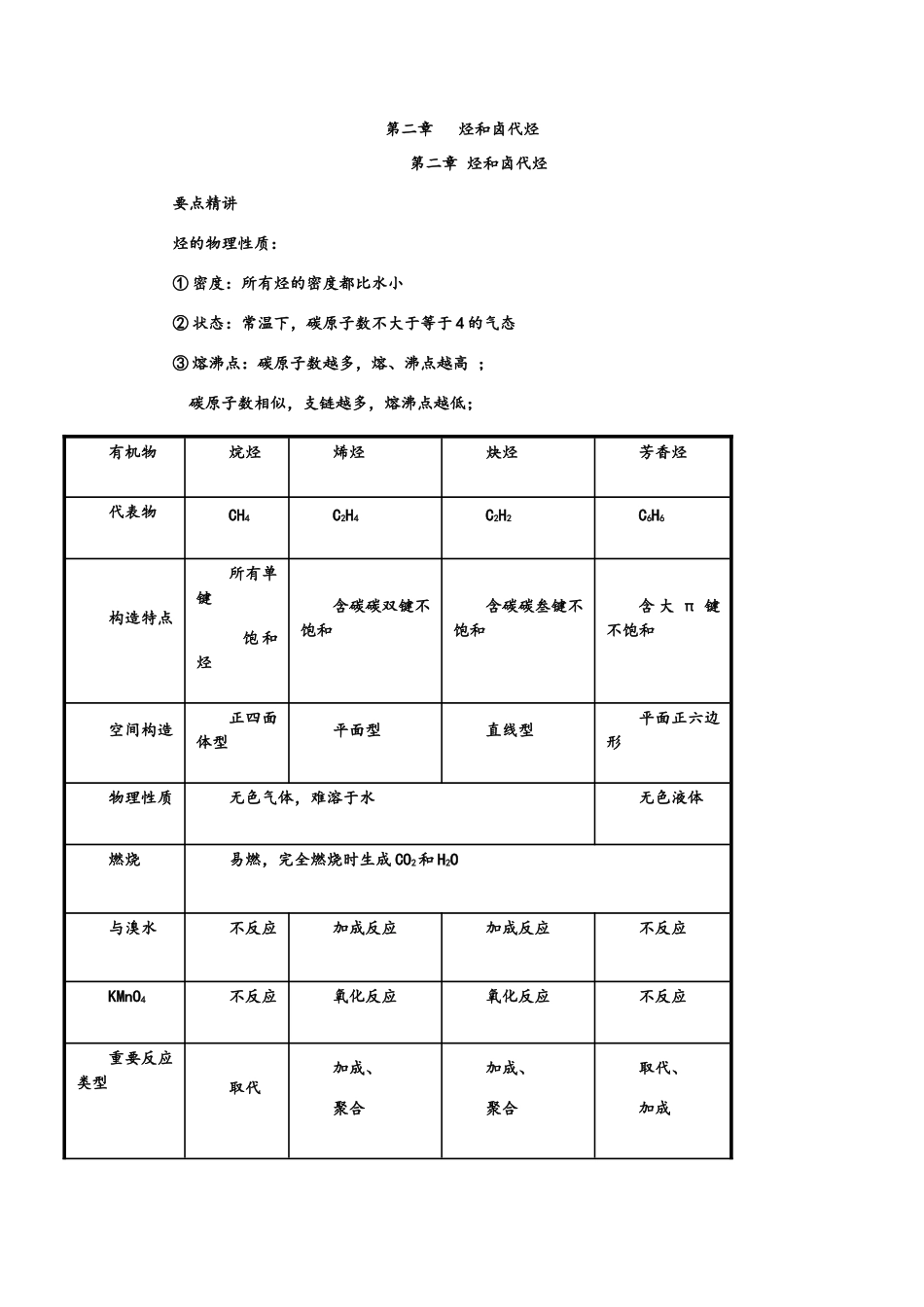
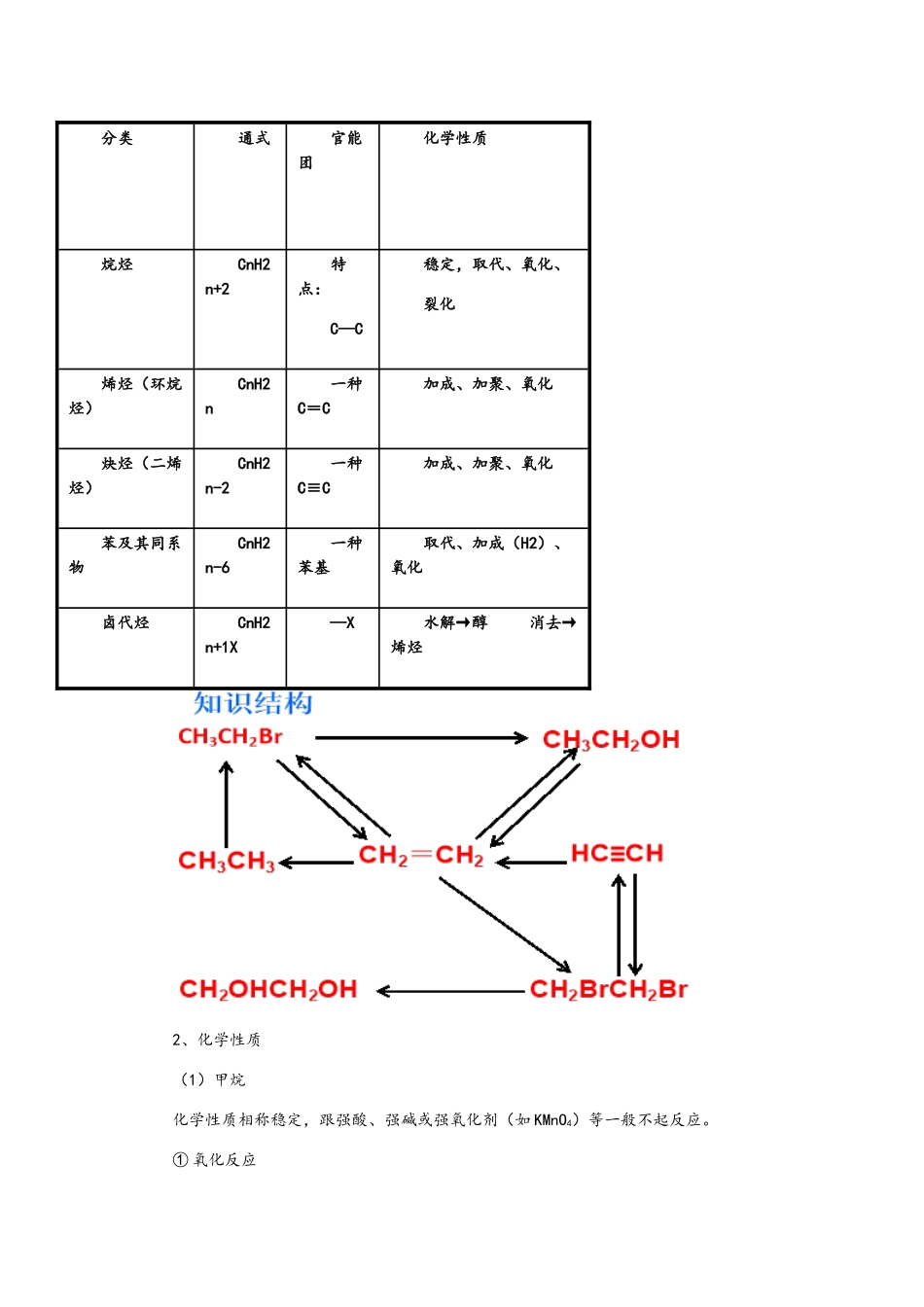
第二章 烃和卤代烃第二章 烃和卤代烃要点精讲烃的物理性质:① 密度:所有烃的密度都比水小 ② 状态:常温下,碳原子数不大于等于 4 的气态 ③ 熔沸点:碳原子数越多,熔、沸点越高 ; 碳原子数相似,支链越多,熔沸点越低;有机物烷烃烯烃炔烃芳香烃代表物CH4C2H4C2H2C6H6构造特点所有单键 饱 和烃含碳碳双键不饱和含碳碳叁键不饱和含 大 π 键不饱和空间构造正四面体型平面型直线型平面正六边形物理性质无色气体,难溶于水无色液体燃烧易燃,完全燃烧时生成 CO2和 H2O与溴水 不反应加成反应加成反应不反应KMnO4 不反应氧化反应氧化反应不反应重要反应类型 取代加成、聚合加成、聚合取代、加成分类通式官能团 化学性质烷烃CnH2n+2特点:C—C稳定,取代、氧化、裂化 烯烃(环烷烃)CnH2n一种C=C 加成、加聚、氧化炔烃(二烯烃)CnH2n-2一种C≡C 加成、加聚、氧化苯及其同系物CnH2n-6一种苯基取代、加成(H2)、氧化卤代烃CnH2n+1X—X水解→醇 消去→烯烃2、化学性质(1)甲烷化学性质相称稳定,跟强酸、强碱或强氧化剂(如 KMnO4)等一般不起反应。① 氧化反应甲烷在空气中安静的燃烧,火焰的颜色为淡蓝色。其燃烧热为 890kJ/mol,则燃烧的热化学方程式为:CH4(g)+2O2(g)CO2(g)+2H2O(l);△H=-890kJ/mol② 取代反应:有机物物分子里的某些原子或原子团被其他原子或原子团所替代的反应。甲烷与氯气的取代反应分四步进行:第一步:CH4+Cl2CH3Cl+HCl 第二步:CH3Cl+ Cl2CH2Cl2+HCl第三步:CH2Cl2+ Cl2CHCl3+HCl 第四步:CHCl3+Cl2CCl4+HCl甲烷的四种氯代物均难溶于水,常温下,只有 CH3Cl 是气态,其他均为液态,CHCl3俗称氯仿,CCl4又叫四氯化碳,是重要的有机溶剂,密度比水大。(2)乙烯① 与卤素单质 X2加成 CH2=CH2+X2→CH2X—CH2X ② 与 H2加成 CH2=CH2+H2 CH3—CH3③ 与卤化氢加成 CH2=CH2+HX→CH3—CH2X ④ 与水加成 CH2=CH2+H2OCH3CH2OH⑤ 氧化反应① 常温下被氧化,如将乙烯通入酸性高锰酸钾溶液,溶液的紫色褪去。⑥ 易燃烧 CH2=CH2+3O22CO2+2H2O 现象(火焰明亮,伴有黑烟)⑦ 加聚反应二、烷烃、烯烃和炔烃 1.概念及通式 (1)烷烃:分子中碳原子之间以单键结合成链状,碳原子剩余的价键所有跟氢原子结合的饱和烃,其通式为:CnH2n+2(n≥l)。 (2)烯烃:分子里具有碳碳双键的不饱和链烃,分子通式为:CnH2n(n≥2)。 (3)炔烃:分子里具有碳碳三...