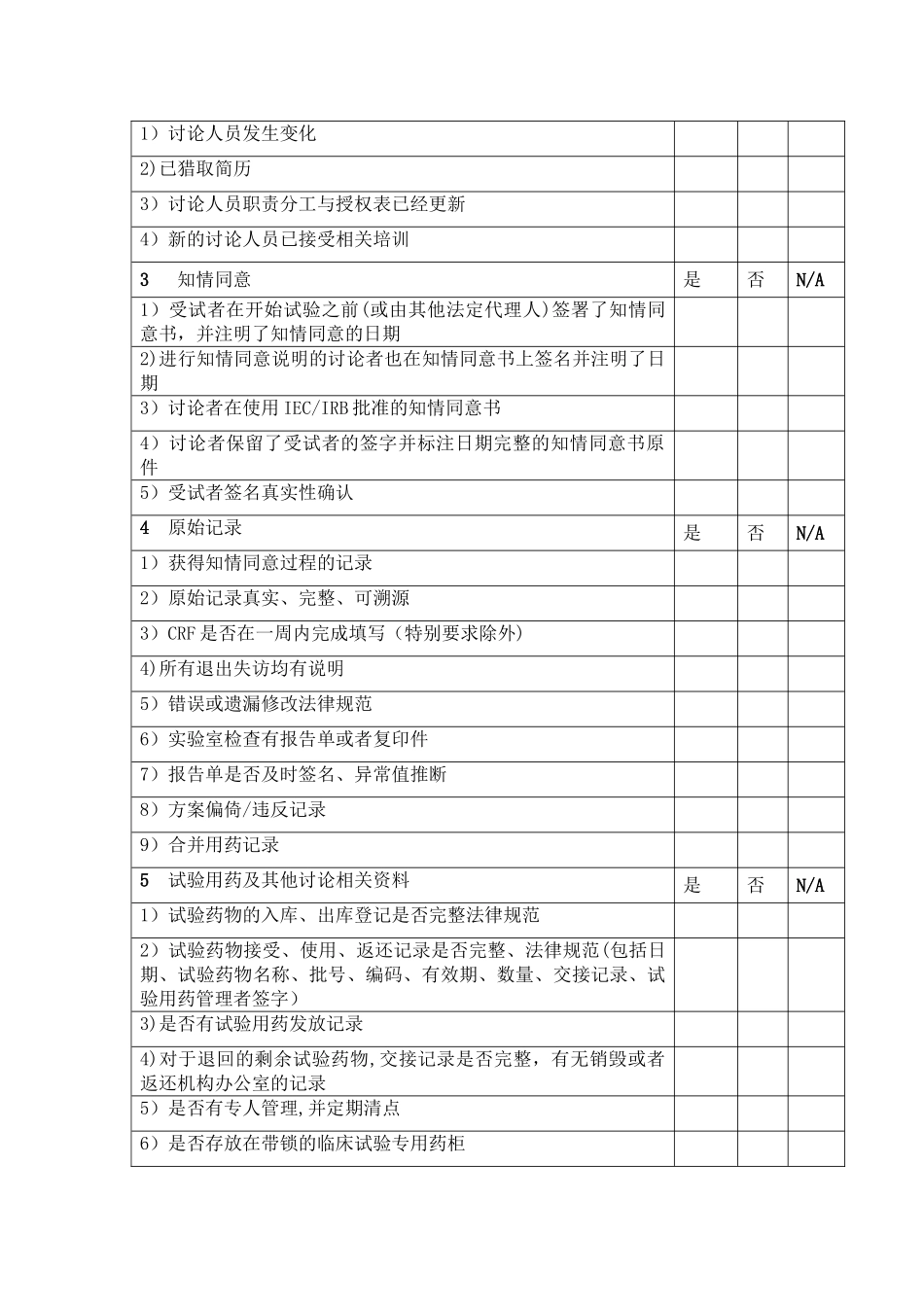
药物临床试验质量控制 SOPⅠ。 目的:为使药物临床试验质量能得到有效的控制,保证试验数据的科学性、可靠性、准确性、完整性以及保障受试者的安全、权益。Ⅱ. 范围:适用于本机构所有药物临床试验的质量控制。Ⅲ。 规程:1。 本单位为组长单位时建议质控人员参加讨论者会议,对临床试验方案、知情同意书以及 CRF 表设计等提出意见.2. 质控人员对在研项目至少在第一例受试者入组后、以及讨论结束资料归档前进行两次质控.试验中期质控(大约入组 50%计划例数或项目进行一年后)进行一次质控。3. 质控组长安排质控人员质控计划和项目。4。 检查前由质控人员通知讨论者做好检查前准备,准备资料包括讨论者手册、原始病历、知情同意书、CRF 表(电子版应确保能够联网检查)等。项目的 CRC 应该积极协助质控部们工作,提供宁静、足够的工作空间。5。 质控员对 CRF 表进行抽查,比例不少于 10-20%,检查例数不少于 5例,如在检查中发现较多问题则增加检查例数,并注意取证。6。 质控员根据质控检查表进行检查并填写质控检查表。检查内容详见质控检查表(见附件 1)。7。 质控员将质控检查表交与讨论者并要求其对检查中发现的问题进行反馈或整改,质控检查表及反馈意见副本由质控组长保存,详见附件 2、3.8. 质控员参加药物临床试验机构“临床试验质量与进度分析汇报会”,质控人员汇报项目质控结果。9。 如日常工作中发现某些项目存在较严重问题,包括对投诉、严重不良事件调查、不法律规范行为等,可由机构办公室组织由专家、办公室主任/副主任、质控员组成的“有因检查小组”对项目进行有因检查。10。 质控员将对既往检查中的问题整改情况进行追踪。11。 PI 对讨论质量负主要责任。PI 应该在项目入组第一例患者时、项目进展中期及项目结题前监督项目质量控制医生根据《项目讨论自查表》(见附件4)完成质控检查,PI 要对项目质量进行抽查考核。项目组应该积极协助药物临床试验机构进行项目质量控制。机构质控员根据整改结果完成《质控情况总结表》(见附件 5)。12。 项目结束时,项目质控员和专业组质控员按要求完成《药物临床试验项目文件检查清单》(见附件 6),补齐缺失的文件、数据和签名后,将所有的原始资料移交机构归档室保管。Ⅳ。 参考依据:《药物临床试验质量管理法律规范》,药物临床试验机构资格认定复核检查标准。Ⅴ。 附件:附件 1 质控检查记录表附件 2 爱尔眼科医院药物临床试验机构项目质量监控...