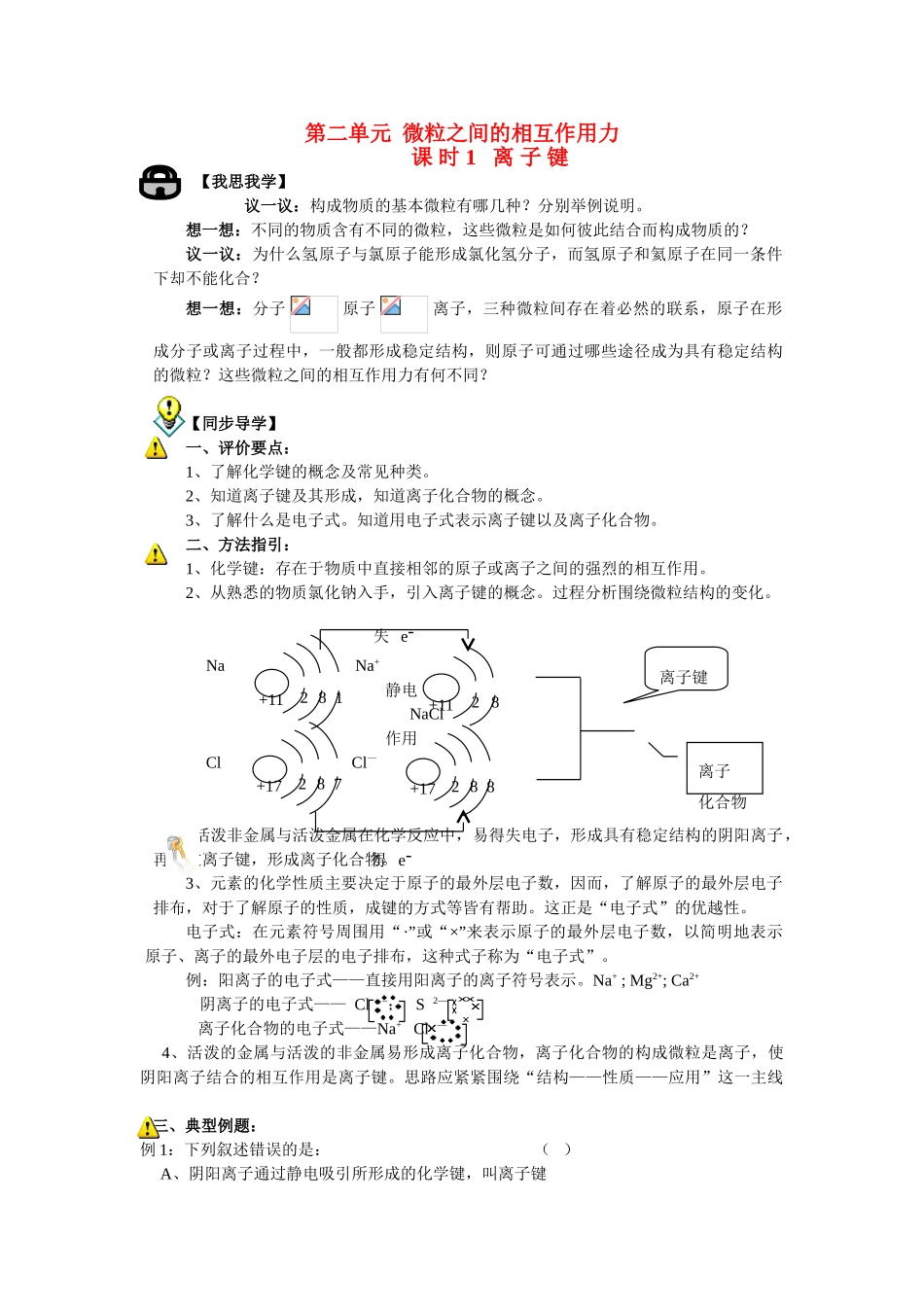
第二单元 微粒之间的相互作用力课 时 1 离 子 键【我思我学】议一议:构成物质的基本微粒有哪几种?分别举例说明。想一想:不同的物质含有不同的微粒,这些微粒是如何彼此结合而构成物质的?议一议:为什么氢原子与氯原子能形成氯化氢分子,而氢原子和氦原子在同一条件下却不能化合?想一想:分子 原子 离子,三种微粒间存在着必然的联系,原子在形成分子或离子过程中,一般都形成稳定结构,则原子可通过哪些途径成为具有稳定结构的微粒?这些微粒之间的相互作用力有何不同?【同步导学】一、评价要点:1、了解化学键的概念及常见种类。2、知道离子键及其形成,知道离子化合物的概念。3、了解什么是电子式。知道用电子式表示离子键以及离子化合物。二、方法指引:1、化学键:存在于物质中直接相邻的原子或离子之间的强烈的相互作用。2、从熟悉的物质氯化钠入手,引入离子键的概念。过程分析围绕微粒结构的变化。 Na Na+ 静电 NaCl 作用 Cl Cl— 活泼非金属与活泼金属在化学反应中,易得失电子,形成具有稳定结构的阴阳离子,再通过离子键,形成离子化合物。3、元素的化学性质主要决定于原子的最外层电子数,因而,了解原子的最外层电子排布,对于了解原子的性质,成键的方式等皆有帮助。这正是“电子式”的优越性。电子式:在元素符号周围用“·”或“×”来表示原子的最外层电子数,以简明地表示原子、离子的最外电子层的电子排布,这种式子称为“电子式”。例:阳离子的电子式——直接用阳离子的离子符号表示。Na+ ; Mg2+; Ca2+ 阴离子的电子式—— Cl —; S 2— 离子化合物的电子式——Na+ Cl — 4、活泼的金属与活泼的非金属易形成离子化合物,离子化合物的构成微粒是离子,使阴阳离子结合的相互作用是离子键。思路应紧紧围绕“结构——性质——应用”这一主线 三、典型例题:例 1:下列叙述错误的是: ( ) A、阴阳离子通过静电吸引所形成的化学键,叫离子键+1182+11821失 e-+17827+17828得 e-离子键离子化合物 B、金属元素与非金属元素化合时,不一定形成离子键 C、某元素的最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键 D、非金属原子间不可能形成离子键。解析:离子键是阴阳离子之间的强烈的相互作用,但这种作用不只是吸引,也存在两种离子核间的斥力和电子间的斥力;典型的活泼金属与活泼非金属之间易形成离子键,对于不太活泼的金属而言,不一定形成离子键;最外层只有一个...