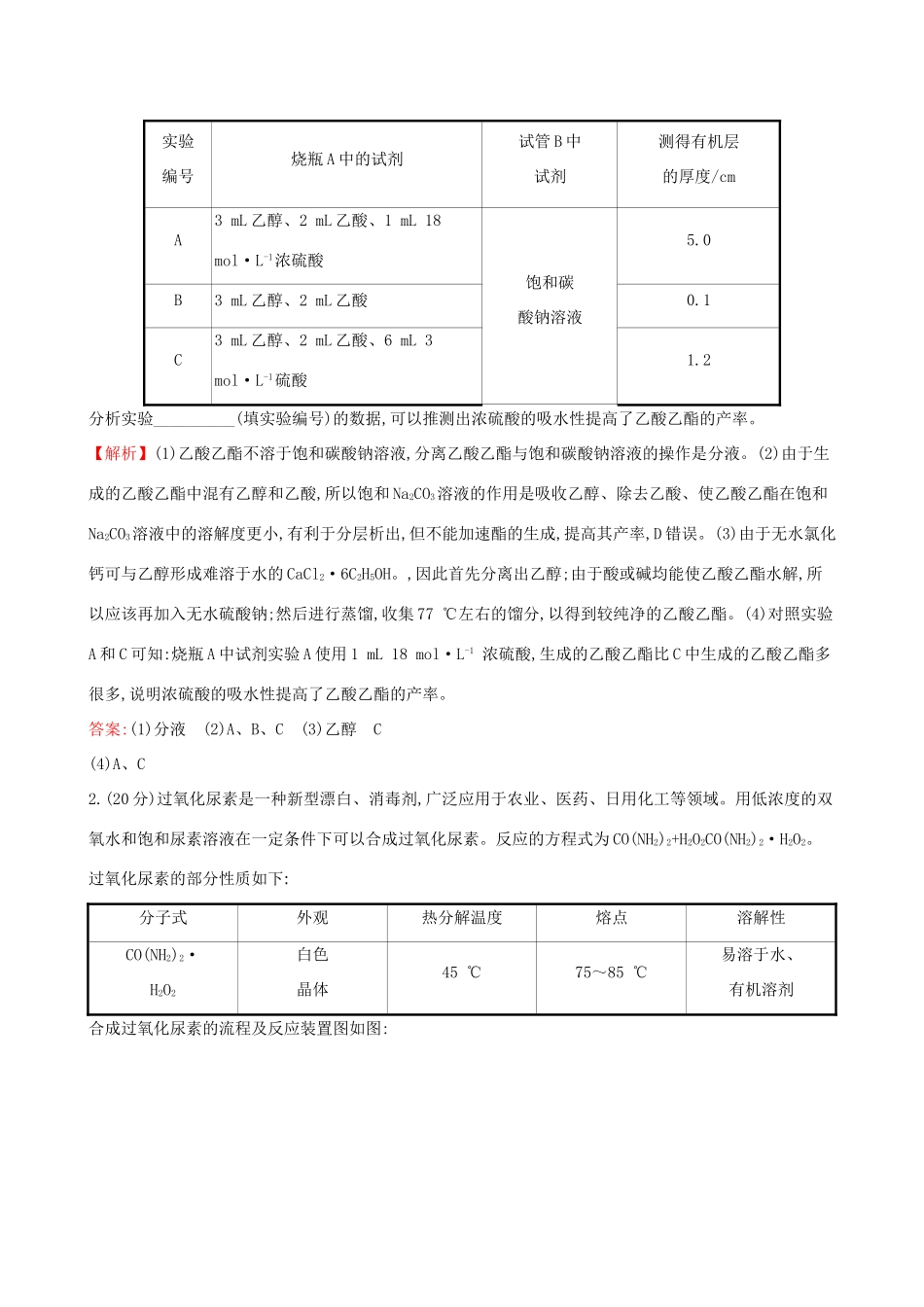
课时梯级作业四十有机实验(45分钟100分)非选择题(本题包括5小题,共100分)1.(20分)(2018·宜春模拟)某校化学探究小组同学为探究乙酸乙酯的制备与水解情况,甲、乙同学分别使用图1、图2装置制备乙酸乙酯。已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。②相关有机物的沸点:试剂乙醚乙醇乙酸乙酸乙酯沸点(℃)34.778.5117.977(1)甲同学在制得乙酸乙酯后,分离乙酸乙酯与饱和碳酸钠溶液的操作是____________。(2)试管中装有饱和Na2CO3溶液,其作用是__________(填序号)。A.吸收乙醇B.除去乙酸C.乙酸乙酯在饱和Na2CO3溶液中的溶解度更小,有利于分层析出D.加速酯的生成,提高其产率(3)甲同学分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出__________;再加入__________(填序号);然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。A.五氧化二磷B.碱石灰C.无水硫酸钠D.生石灰(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,乙同学利用图2所示装置进行了以下3个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡试管B,再测有机层的厚度,实验记录如下:实验编号烧瓶A中的试剂试管B中试剂测得有机层的厚度/cmA3mL乙醇、2mL乙酸、1mL18mol·L-1浓硫酸饱和碳酸钠溶液5.0B3mL乙醇、2mL乙酸0.1C3mL乙醇、2mL乙酸、6mL3mol·L-1硫酸1.2分析实验__________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。【解析】(1)乙酸乙酯不溶于饱和碳酸钠溶液,分离乙酸乙酯与饱和碳酸钠溶液的操作是分液。(2)由于生成的乙酸乙酯中混有乙醇和乙酸,所以饱和Na2CO3溶液的作用是吸收乙醇、除去乙酸、使乙酸乙酯在饱和Na2CO3溶液中的溶解度更小,有利于分层析出,但不能加速酯的生成,提高其产率,D错误。(3)由于无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。,因此首先分离出乙醇;由于酸或碱均能使乙酸乙酯水解,所以应该再加入无水硫酸钠;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。(4)对照实验A和C可知:烧瓶A中试剂实验A使用1mL18mol·L-1浓硫酸,生成的乙酸乙酯比C中生成的乙酸乙酯多很多,说明浓硫酸的吸水性提高了乙酸乙酯的产率。答案:(1)分液(2)A、B、C(3)乙醇C(4)A、C2.(20分)过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为CO(NH2)2+H2O2CO(NH2)2·H2O2。过氧化尿素的部分性质如下:分子式外观热分解温度熔点溶解性CO(NH2)2·H2O2白色晶体45℃75~85℃易溶于水、有机溶剂合成过氧化尿素的流程及反应装置图如图:请回答下列问题:(1)仪器X的名称是__________;X中冷却水从__________(填“a”或“b”)口出来。(2)该反应的温度控制30℃而不能过高的原因是_________。(3)步骤①宜采用的操作是__________(填字母)。A.加热蒸发B.常压蒸发C.减压蒸发(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是______________。(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L-1H2SO4,用0.2000mol·L-1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为__________;若滴定后俯视读数,则测得的过氧化尿素含量__________(填“偏高”“偏低”或“不变”)。【解析】(1)仪器X的名称是球形冷凝管;冷凝管中冷却水采用逆流的方法进出,所以下口a是进水口,上口b是出水口。(2)双氧水和过氧化尿素在温度高时易分解,为防止双氧水和过氧化尿素分解,所以需要温度控制为30℃而不能过高。(3)加热易导致双氧水和过氧化尿素分解,所以需要减压蒸发、冷却结晶、过滤得到产品。(4)晶体洗涤方法:沿玻璃棒注入蒸馏水至浸没晶体表面,静置待水自然流下,重复操作2~3次。(5)已知尿素与KMnO4溶液不反应,发生的反应为5H2O2+2KMnO4+3H2SO48H2O+2MnSO4+K2SO4+5O2↑,5H2O2~2KMnO452n0.2000mol·L-1×0.018L则n=0.009mol,所以CO(NH2)2·H2O2为0.009mol,其质量为0.009mol×94g·mol-1=0.846g。所以产品中CO(NH2)2·H2O2的质量分数为×100%=84.6%;若滴...