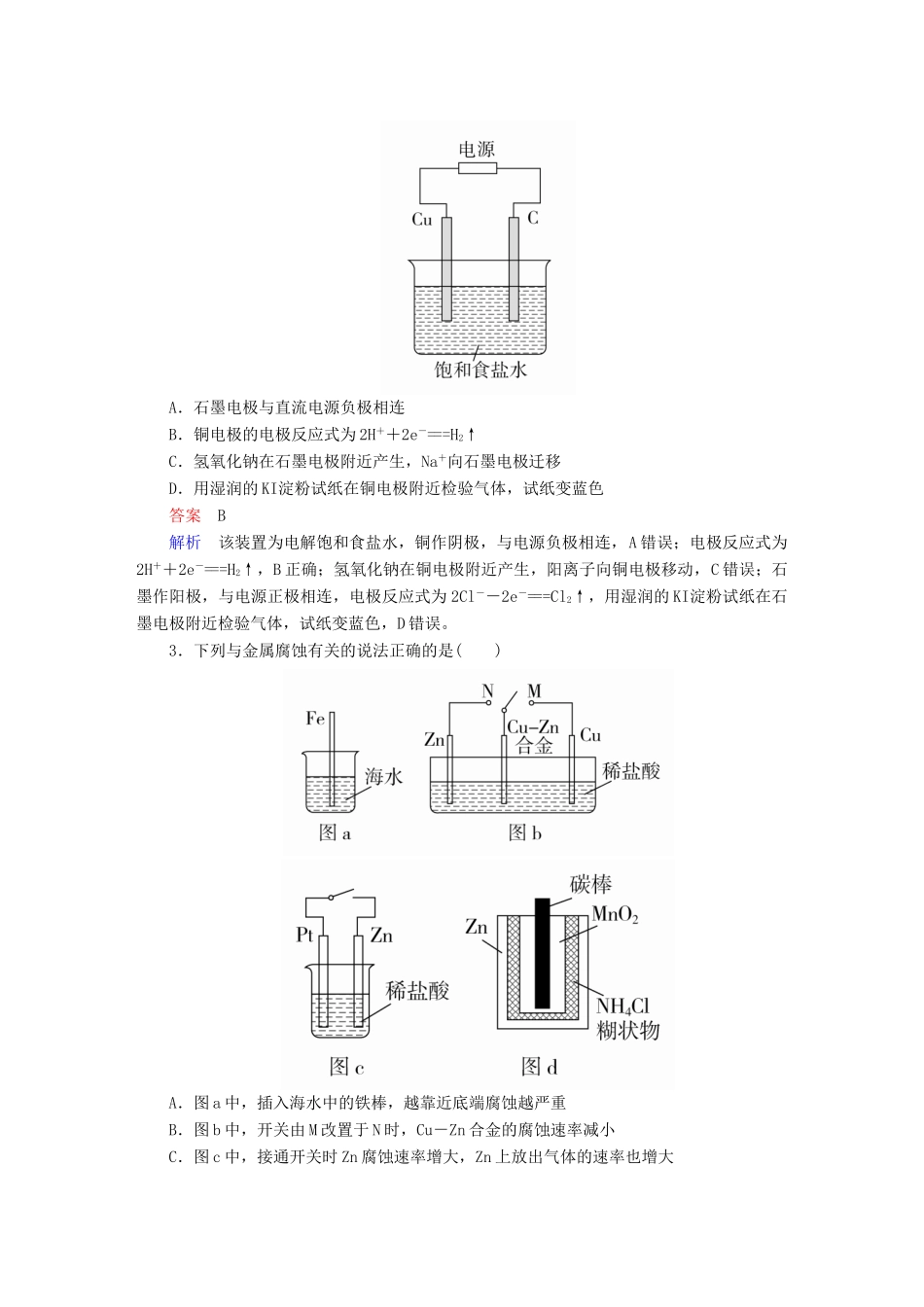
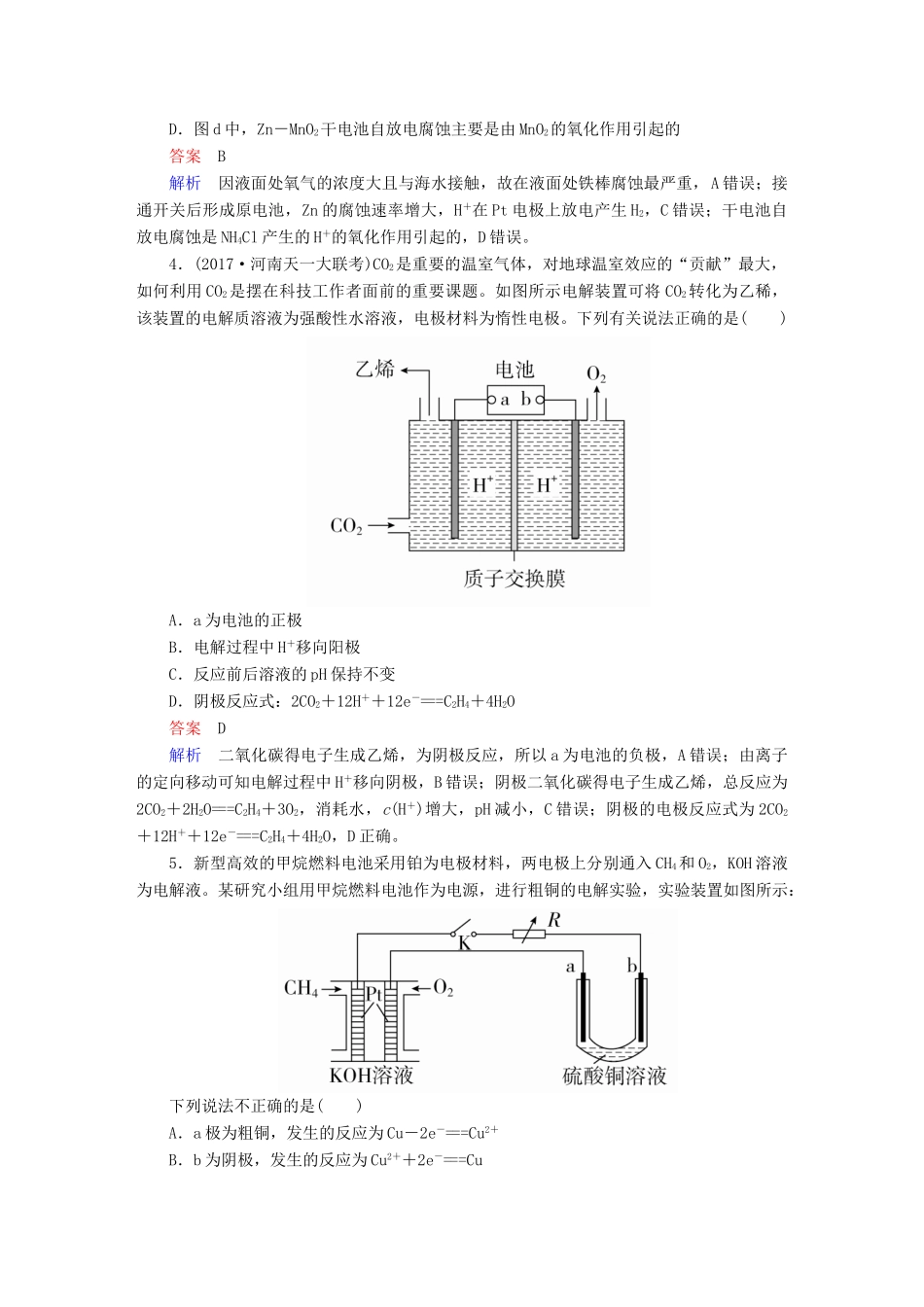
第32讲电解原理金属的腐蚀和防护(建议用时:40分钟)一、选择题(每题8分,共72分)1.下列关于电化学知识的说法正确的是()A.电解饱和食盐水在阳极得到氯气,阴极得到金属钠B.电解精炼铜时,阳极质量的减少不等于阴极质量的增加C.电解AlCl3、FeCl3、CuCl2的混合溶液,在阴极上依次析出Al、Fe、CuD.电解CuSO4溶液一段时间后(Cu2+未反应完),加入适量Cu(OH)2可以使溶液恢复至原状态答案B2.(2017·广东惠州调研)某同学设计下图装置探究氯碱工业原理,下列说法正确的是()A.石墨电极与直流电源负极相连B.铜电极的电极反应式为2H++2e-===H2↑C.氢氧化钠在石墨电极附近产生,Na+向石墨电极迁移D.用湿润的KI淀粉试纸在铜电极附近检验气体,试纸变蓝色答案B解析该装置为电解饱和食盐水,铜作阴极,与电源负极相连,A错误;电极反应式为2H++2e-===H2↑,B正确;氢氧化钠在铜电极附近产生,阳离子向铜电极移动,C错误;石墨作阳极,与电源正极相连,电极反应式为2Cl--2e-===Cl2↑,用湿润的KI淀粉试纸在石墨电极附近检验气体,试纸变蓝色,D错误。3.下列与金属腐蚀有关的说法正确的是()A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的答案B解析因液面处氧气的浓度大且与海水接触,故在液面处铁棒腐蚀最严重,A错误;接通开关后形成原电池,Zn的腐蚀速率增大,H+在Pt电极上放电产生H2,C错误;干电池自放电腐蚀是NH4Cl产生的H+的氧化作用引起的,D错误。4.(2017·河南天一大联考)CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题。如图所示电解装置可将CO2转化为乙稀,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极。下列有关说法正确的是()A.a为电池的正极B.电解过程中H+移向阳极C.反应前后溶液的pH保持不变D.阴极反应式:2CO2+12H++12e-===C2H4+4H2O答案D解析二氧化碳得电子生成乙烯,为阴极反应,所以a为电池的负极,A错误;由离子的定向移动可知电解过程中H+移向阴极,B错误;阴极二氧化碳得电子生成乙烯,总反应为2CO2+2H2O===C2H4+3O2,消耗水,c(H+)增大,pH减小,C错误;阴极的电极反应式为2CO2+12H++12e-===C2H4+4H2O,D正确。5.新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,KOH溶液为电解液。某研究小组用甲烷燃料电池作为电源,进行粗铜的电解实验,实验装置如图所示:下列说法不正确的是()A.a极为粗铜,发生的反应为Cu-2e-===Cu2+B.b为阴极,发生的反应为Cu2++2e-===CuC.电池负极发生的反应为2O2+4H2O+8e-===8OH-D.甲烷电池中,溶液的pH逐渐减小答案C解析根据甲烷燃烧的化学方程式可知,甲烷作还原剂,在负极发生反应CH4+10OH--8e-===CO+7H2O,氧气在正极发生反应2O2+4H2O+8e-===8OH-,C错误;根据正负极反应生成和消耗OH-量的关系得出反应过程中溶液的pH逐渐减小,D正确;电解精炼铜时,与电源正极相连的是粗铜,与电源负极相连的是纯铜,故a极是粗铜,发生的反应为Cu-2e-===Cu2+,A正确;b极是纯铜,发生的反应为Cu2++2e-===Cu,B正确。6.用石墨作电极电解0.1mol·L-1的NaCl溶液,通电一段时间后发现两极收集的气体体积之比为4∶3(不考虑气体的溶解),下列说法正确的是()A.在电解后的溶液中注入一定量的盐酸可以使溶液恢复到原始状态B.在电解质溶液中通入标准状况下4.48L的氯化氢气体并注入0.1mol的水可以使溶液恢复到原始状态C.阴极产生的气体的物质的量是阳极产生气体的物质的量的0.75倍D.阳极产生的气体的平均摩尔质量为58g/mol答案D解析分析电解NaCl溶液过程,阳极产生Cl2,阴极产生H2,而由得失电子守恒可知生成的Cl2和H2的体积应该相等,现两极收集的气体体积之比为4∶3,说明发生了过度电解,Cl-完全放电后OH-放电生成O2,假设电解过程中生成了amolH2、bmolO2、cmolCl2,则a∶(b+c)=4∶3,再由得失电子守恒可知...