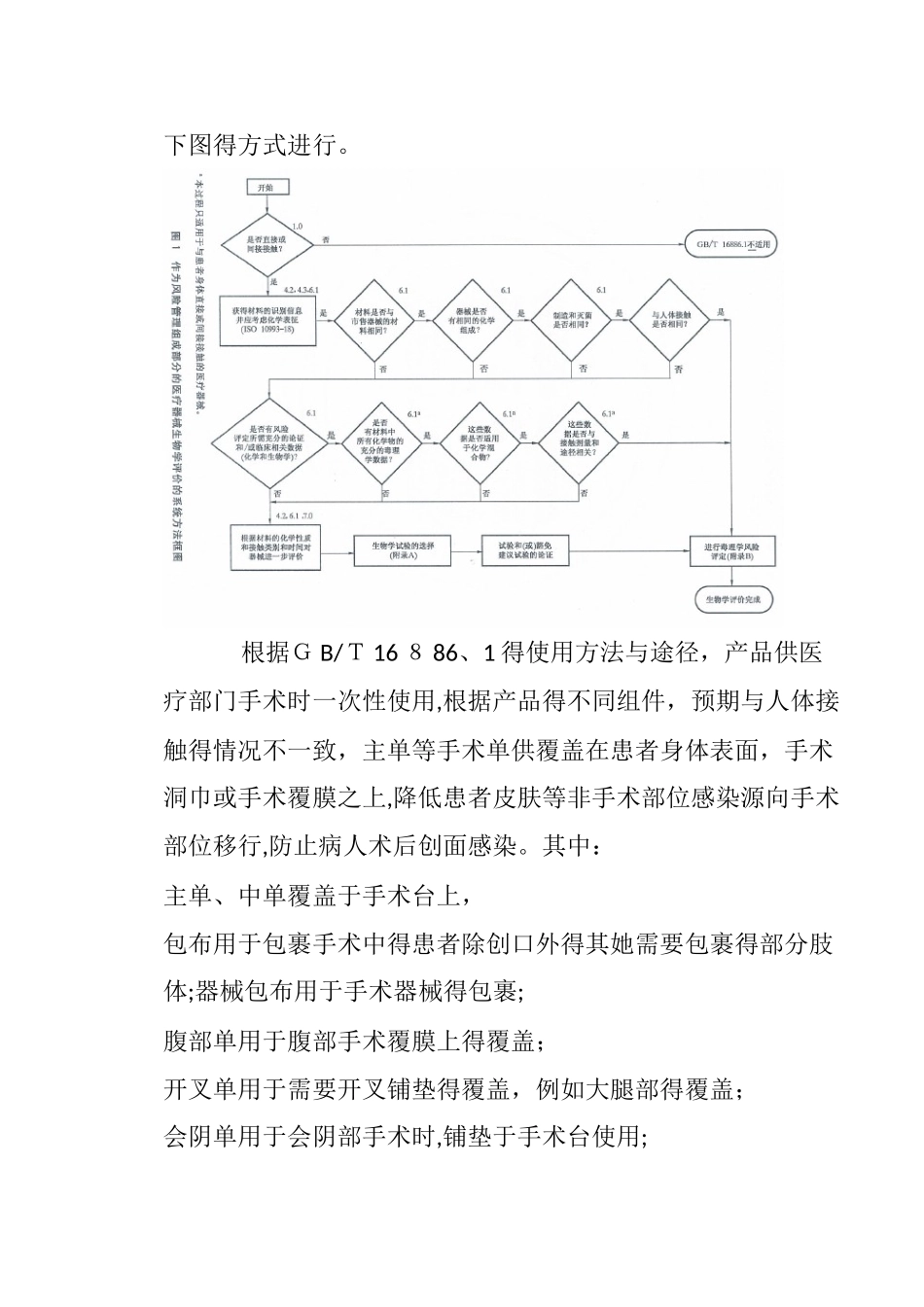
附件 2:生物相容性讨论资料1. 概要1-1)介绍:该分析就是针对公司得“一次性使用手术巾包”进行得,我们为讨论该产品得就是否需要进行生物相容性试验。1-2)责任:1. 技术经理 -所提供得生物相容性评估政策与目标 -评估生物相容性讨论2、 项目经理— 生物相容性评估报告得审查与批准 1-3) 背景: 关于最终产品,对直接/间接与病人与操作人员接触得材料得生物相容性进行评估。 2、 讨论目标、讨论标准与方法 根据 GB/T 16886、1中得方法进行生物相容性得讨论。 3、 讨论分析数据 根据 G B/T 1 6886、1标准,生物相容性讨论根据下图得方式进行。 根据G B/T 16 8 86、1 得使用方法与途径,产品供医疗部门手术时一次性使用,根据产品得不同组件,预期与人体接触得情况不一致,主单等手术单供覆盖在患者身体表面,手术洞巾或手术覆膜之上,降低患者皮肤等非手术部位感染源向手术部位移行,防止病人术后创面感染。其中:主单、中单覆盖于手术台上,包布用于包裹手术中得患者除创口外得其她需要包裹得部分肢体;器械包布用于手术器械得包裹;腹部单用于腹部手术覆膜上得覆盖;开叉单用于需要开叉铺垫得覆盖,例如大腿部得覆盖;会阴单用于会阴部手术时,铺垫于手术台使用;臀底单用于铺垫于臀底部手术台用。手术衣为临床医务人员在工作时接触到得具有潜在感染性得患者血液、体液、分泌物等提供阻隔及一次性防护用.产品在使用过程中作为垫单或者铺单或者覆盖在洞巾等手术覆膜上使用,不与人体伤口/创口接触;手术衣为医生在手术过程中防护使用,不与人体伤口/创口接触。根据途径选择: 根据人体接触性质分类:产品属于与人体表面接触,皮肤接触得器械。根据接触时间分类:产品属于短期接触(A):在 24 小时内一次、多次或者重复使用或接触得器械。根据 GB/T168 86、1 生物相容性评价框图,根据G B/T16886、1 附录 A 中表 A、1中确定,产品需要进行细胞毒性、刺激与致敏反应三项评价。据此,产品得生物相容性评价要求为:1、细胞毒性试验:应不大于1级反应.2、 迟发型超敏反应试验:应无致敏反应。3、原发性皮肤刺激试验:应无刺激性.手术衣通过广州医疗器械质量监督检验中心进行检测,报告号:wt16 0 8057 4,检测结果为: 1、细胞毒性:细胞毒性反应分级为0级,结论符合; 2、迟发型超敏反应试验:无致敏反应,结论符合;3、原发性皮肤刺激试验:极轻微刺激,结论符合。手术单(主单、包布、器械包布、中单、治疗...