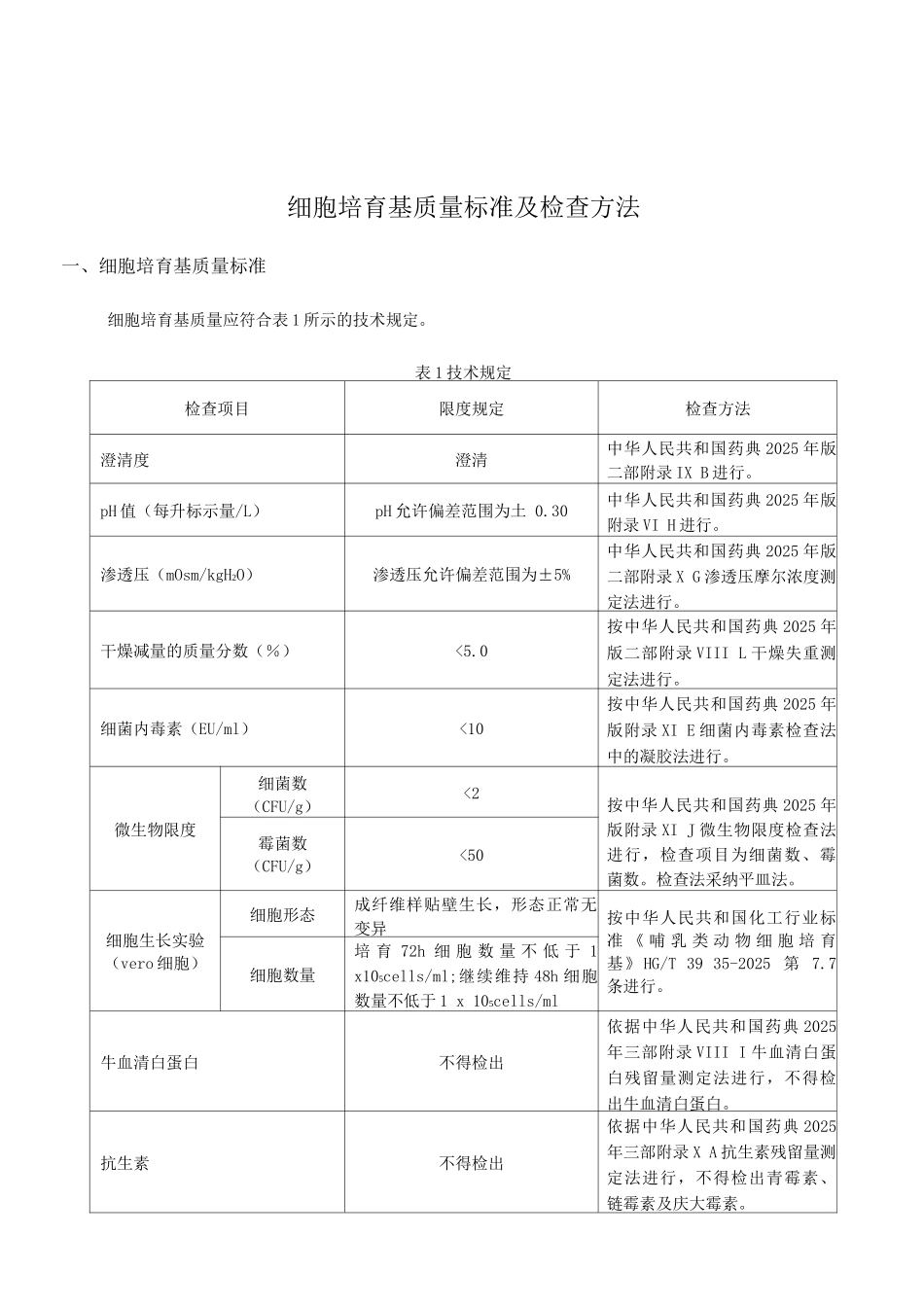
细胞培育基质量标准及检查方法中国医药生物技术协会四月编写说明一、根据中国医药生物技术协会 2025 年 9 月 20 日组织召开的《动物细胞培育基生产管理及质量控制学术研讨会》纪要,结合我国的实际情况制定本标准。二、本标准以《中国药典》2025 版和《哺乳类动物细胞培育基》(HG/T 3935-2025)行业标准为依据,结合生物制品对细胞培育基原材料的特别规定制定,增长了牛血清白蛋白残留量、抗生素残留量等检测项目。三、本标准分为细胞培育基检查项目和每个项目的检查方法两部分,为评判细胞培育基产品质量提供了依据和方法,从而法律规范我国细胞培育基行业健康进展。四、结果评估依据本标准和方法对细胞培育基样品进行全项检查,所有项目均符合标准规定,鉴定该样品为合格;若有一项不符合标准规定,则鉴定样品为不合格。细胞培育基质量标准及检查方法一、细胞培育基质量标准细胞培育基质量应符合表 1 所示的技术规定。表 1 技术规定检查项目限度规定检查方法澄清度澄清中华人民共和国药典 2025 年版二部附录 IX B 进行。pH 值(每升标示量/L)pH 允许偏差范围为土 0.30中华人民共和国药典 2025 年版附录 VI H 进行。渗透压(mOsm/kgH2O)渗透压允许偏差范围为±5%中华人民共和国药典 2025 年版二部附录 X G 渗透压摩尔浓度测定法进行。干燥减量的质量分数(%)<5.0按中华人民共和国药典 2025 年版二部附录 VIII L 干燥失重测定法进行。细菌内毒素(EU/ml)<10按中华人民共和国药典 2025 年版附录 XI E 细菌内毒素检查法中的凝胶法进行。微生物限度细菌数(CFU/g)<2按中华人民共和国药典 2025 年版附录 XI J 微生物限度检查法进行,检查项目为细菌数、霉菌数。检查法采纳平皿法。霉菌数(CFU/g)<50细胞生长实验(vero 细胞)细胞形态成纤维样贴壁生长,形态正常无变异按中华人民共和国化工行业标准 《 哺 乳 类 动 物 细 胞 培 育基》HG/T 39 35-2025 第 7.7条进行。细胞数量培 育 72h 细 胞 数 量 不 低 于 1 x105cells/ml;继续维持 48h 细胞数量不低于 1 x 105cells/ml牛血清白蛋白不得检出依据中华人民共和国药典 2025年三部附录 VIII I 牛血清白蛋白残留量测定法进行,不得检出牛血清白蛋白。抗生素不得检出依据中华人民共和国药典 2025年三部附录 X A 抗生素残留量测定法进行,不得检出青霉素、链霉素及庆大霉素。二、检查方法除非另有说明,检查中...