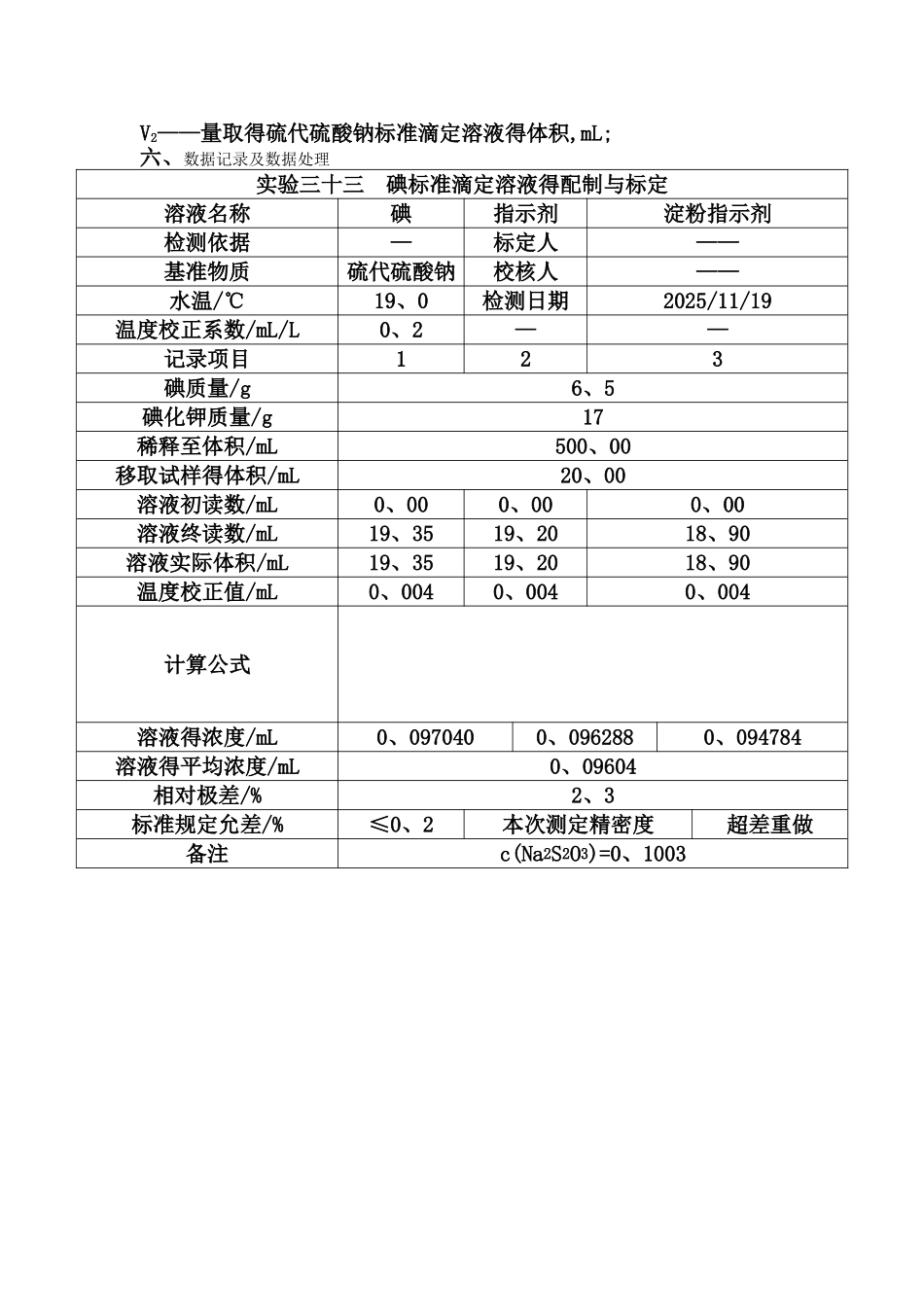
化学分析实验报告(Ⅱ)专业:工业分析与检验班级:1432 班 实训人员:第一项目组指导老师:张华君检测日期:20251119验三十三 碘标准滴定溶液得配制与标定一、实验目得1、掌握碘标准滴定溶液得配制方法与保存方法。2、掌握碘标准滴定溶液得标定方法、基本原理、反应条件与操作技术。二、实验原理碘可以通过升华法制得纯试剂,但因其升华及对天平有腐蚀性,故不宜用直接法配制 I2标准溶液而采纳间接法。可以用基准物质 As2O3来标定 I2溶液。As2O3难溶液于水,可溶于碱溶液中,与 NaOH 反应生成亚砷酸钠,用 I2溶液进行滴定。反应式为:该反应为可逆反应,在中性或微碱性溶液中(pH≈8),反应能定量地向右进行,可加固体 NaHCO3以中与反应生成得 H+,保持 pH=8 左右。在酸性溶液中,反应向左进行,即 AsO43氧化 I 析出 I2。由标定反应式可知,As2O3与 I2得基本单元分别为 1/4As2O3与 1/2I2。也可以用 Na2S2O3 标准溶液“比较”,用 I2 溶液滴定一定体积得Na2S2O3标准溶液反应为:I2+2S2O32→2I+S4O62以淀粉为指示剂,终点由无色到蓝色。三、试剂固体试剂 I2(分析纯)、固体试剂 KI(分析纯)、固体试剂 NaHCO3(分析纯)、H2SO4 溶液、淀粉试剂(10g/L)、酚酞指示剂(10g/L)、硫代硫酸钠标准滴定溶液。四、实验步骤1、配制 c(1/2I2)=0、1mol/L 得碘溶液 500mL。称取 6、5gI2放于小烧杯中,称取 17gKI,准备蒸馏水 500mL,将 KI 分4~5 次放入装有 I2得小烧杯中,每次加水 5~10mL,用玻璃棒轻轻研磨,使碘逐渐溶解,溶解部分转入棕色试剂瓶中,如此反复直至碘片全部溶解为止。用水多次清洗烧杯并转入试剂瓶中,剩余得水全部加入试剂瓶中稀释,盖好瓶盖,摇匀,待标定。2、标定用滴定管准确放出配制好得硫代硫酸钠标准滴定溶液 20mL,置于容量瓶中,再加入 2mL 得淀粉指示液(10g/L),用配制好得碘溶液滴定至溶液蓝色刚好出现即为终点。记录消耗得 I2溶液得体积。平行测定3 次。同时做水消耗碘得空白试验。五、数据处理 C——硫代硫酸钠标准滴定溶液得浓度,mol/L;V1——滴定消耗得碘溶液得体积,mL;V2——量取得硫代硫酸钠标准滴定溶液得体积,mL;六、数据记录及数据处理实验三十三 碘标准滴定溶液得配制与标定溶液名称碘指示剂淀粉指示剂检测依据—标定人——基准物质硫代硫酸钠校核人——水温/℃19、0 检测日期2025/11/19温度校正系数/mL/L0、2——记录项目123碘质量/g6、5碘化钾质量/g17稀释至体积/mL500、00 移取试样得体积/mL20、00 溶液初读数/mL...