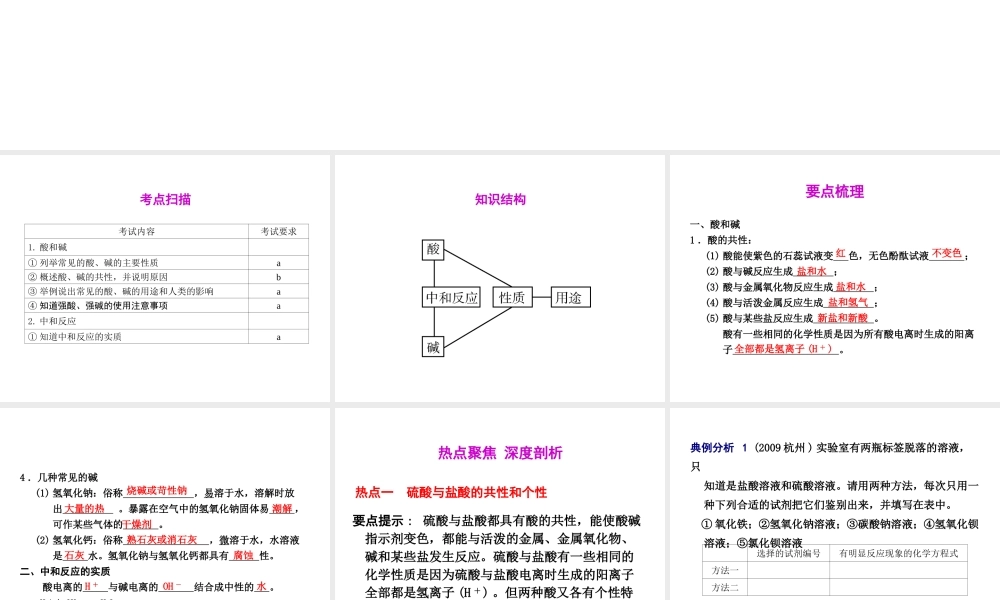
第 35 课 常见的化合物( 一 ) 考点扫描考试内容考试要求1. 酸和碱① 列举常见的酸、碱的主要性质a② 概述酸、碱的共性,并说明原因b③ 举例说出常见的酸、碱的用途和人类的影响a④ 知道强酸、强碱的使用注意事项a2. 中和反应① 知道中和反应的实质a知识结构要点梳理一、酸和碱1 .酸的共性: (1) 酸能使紫色的石蕊试液变 色,无色酚酞试液 ; (2) 酸与碱反应生成 ; (3) 酸与金属氧化物反应生成 ; (4) 酸与活泼金属反应生成 ; (5) 酸与某些盐反应生成 。 酸有一些相同的化学性质是因为所有酸电离时生成的阳离 子 。红不变色盐和水盐和水盐和氢气新盐和新酸全部都是氢离子 (H + )4 .几种常见的碱 (1) 氢氧化钠:俗称 ,易溶于水,溶解时放 出 。暴露在空气中的氢氧化钠固体易 , 可作某些气体的 。 (2) 氢氧化钙:俗称 ,微溶于水,水溶液 是 水。氢氧化钠与氢氧化钙都具有 性。二、中和反应的实质 酸电离的 与碱电离的 结合成中性的 。 H ++ OH -===H2O烧碱或苛性钠大量的热潮解干燥剂熟石灰或消石灰腐蚀石灰H +OH -水热点聚焦 深度剖析要点提示 : 硫酸与盐酸都具有酸的共性,能使酸碱指示剂变色,都能与活泼的金属、金属氧化物、碱和某些盐发生反应。硫酸与盐酸有一些相同的化学性质是因为硫酸与盐酸电离时生成的阳离子全部都是氢离子 (H +) 。但两种酸又各有个性特点。热点一 硫酸与盐酸的共性和个性典例分析 1 (2009 杭州 ) 实验室有两瓶标签脱落的溶液,只 知道是盐酸溶液和硫酸溶液。请用两种方法,每次只用一 种下列合适的试剂把它们鉴别出来,并填写在表中。 ① 氧化铁;②氢氧化钠溶液;③碳酸钠溶液;④氢氧化钡 溶液;⑤氯化钡溶液选择的试剂编号有明显反应现象的化学方程式方法一方法二解析 : 硫酸与盐酸都能与氧化铁、氢氧化钠溶液、碳酸钠溶液反应,现象相同。硫酸与氢氧化钡溶液、氯化钡溶液反应能产生白色沉淀。答案 : ④ H2SO4+ Ba(OH)2===BaSO4↓ + 2H2O ⑤ H2SO4+ BaCl2===BaSO4↓ + 2HCl对点训练 1 .欲除去下列各物质中的少量杂质 ( 括号内的物质为杂质 ) ,同 时,又不能引入新的杂质,分别写出所加试剂和发生反应的 化学方程式。 物质及杂质所加试剂除杂原理(1)NaCl(Na2CO3)(2)HNO3(HCl)(3)Na2SO4(Na2CO3)(4)HCl(H2SO4)答案 : (1) 稀盐酸 Na2CO3 + 2HCl===2NaCl + H2O + CO2↑ (2) 硝酸...