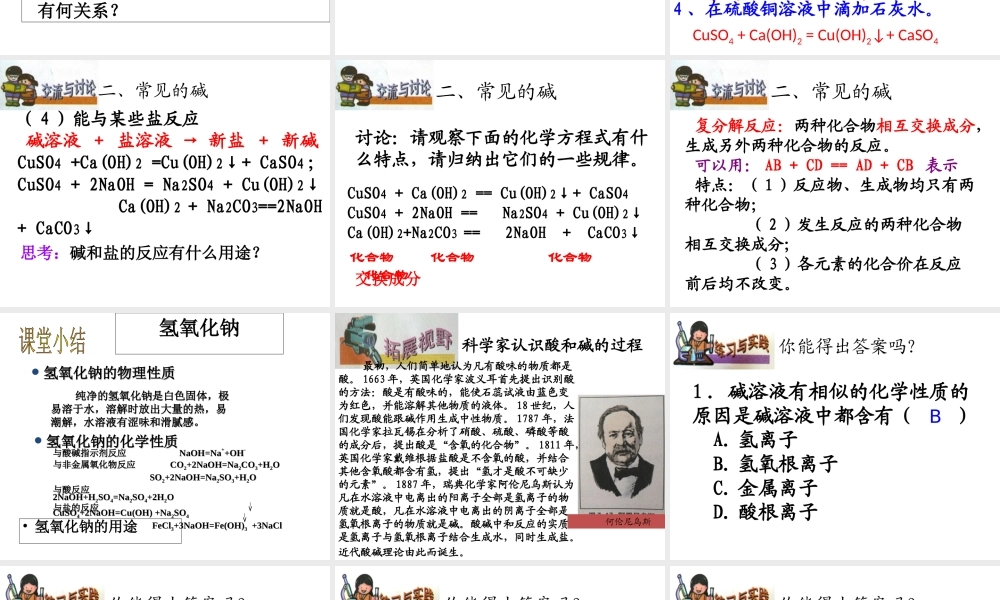
碱的通性碱的共同性质二、常见的碱由于碱电离后都能生成 OH- ,因此也具有相同的性质。( 1 )与酸碱指示剂作用 A .紫色石蕊试剂遇到碱溶液变蓝; B .无色酚酞遇到碱溶液变红提醒:可溶性的碱才具有这样的性质 提问1 、如何检验二氧化碳气体?写出化学方程式。2 、除去混合气体中的二氧化碳,用什么吸收好?写出相应的化学方程式。3 、以上信息,你能总结出碱具有什么化学性质吗?请用通式表示。4 、写出 SO2 、 SO3 分别和 NaOH 、 Ca(OH)2发生反应的化学方程式。( 2 )与某些非金属氧化物反应碱溶液 + 非金属氧化物 → 盐 + 水如: 2NaOH + CO2 == Na2CO3 + H2O ; Ca(OH)2 + SO2 == CaSO3↓ + H2O ; 二、常见的碱提问:非金属氧化物与碱的反应属于基本反应类型吗?为什么氢氧化钠固体要密封保存? 提问1 、写出氢氧化铜与硫酸、氢氧化铁与盐酸反应的化学方程式。2 、以上事实说明碱具有什么化学性质?3 、什么是中和反应?它与复分解反应有何关系?( 3 )与酸反应(中和反应)碱 + 酸 → 盐 + 水如: NaOH + HCl == NaCl + H2O ; Ca(OH)2 + H2SO4 == CaSO4 + 2H2O ; 二、常见的碱1 、在硫酸铜溶液中滴加氢氧化钠溶液。2 、在氯化铁溶液中滴加氢氧化钠溶液。3 、在碳酸钠溶液中滴加石灰水。4 、在硫酸铜溶液中滴加石灰水。探究四:CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaClNa2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOHCuSO4 + Ca(OH)2 = Cu(OH)2↓+ CaSO4( 4 )能与某些盐反应碱溶液 + 盐溶液 → 新盐 + 新碱CuSO4 +Ca(OH)2 =Cu(OH)2↓+ CaSO4 ;CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ Ca(OH)2 + Na2CO3==2NaOH + CaCO3↓二、常见的碱思考:碱和盐的反应有什么用途?CuSO4 + Ca(OH)2 == Cu(OH)2↓+ CaSO4CuSO4 + 2NaOH == Na2SO4 + Cu(OH)2↓Ca(OH)2+Na2CO3 == 2NaOH + CaCO3↓二、常见的碱讨论:请观察下面的化学方程式有什么特点,请归纳出它们的一些规律。化合物 化合物 化合物 化合物交换成分二、常见的碱复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应。可以用: AB + CD == AD + CB 表示特点:( 1 )反应物、生成物均只有两种化合物; ( 2 )发生反应的两种化合物相互交换成分; ( 3 )各元素的化合价在反应前后均不改变。• ...