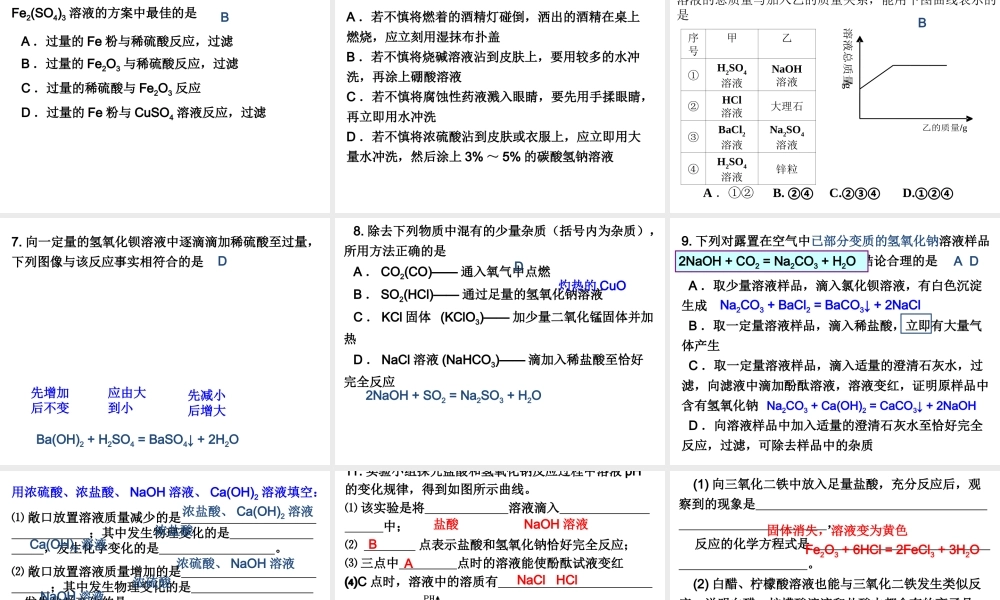
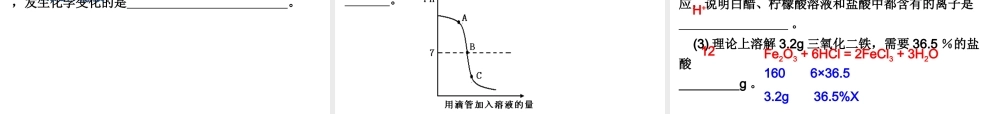
第 11 讲 常见的酸和碱一、酸碱指示剂1. 定义:用于检验溶液的 的物质称为酸碱指示剂,简称 。酸碱性指示剂2. 常见指示剂(石蕊试液、酚酞试液)在不同溶液中显示的颜色酸性溶液中性溶液碱性溶液紫色石蕊试液无色酚酞试液红色紫色蓝色无色无色红色二、常见的酸1 、常见酸的物理性质和主要用途浓盐酸浓硫酸化学式色、态气味挥发性吸水性用途HClH2SO4无色液体无色粘稠状液体有刺激性气味无味易挥发难挥发无吸水性有吸水性金属 ,制造药物,胃液中的盐酸能 等。除锈助消化金属 ,冶炼金属、做 剂等。除锈干燥思考 1. 浓盐酸和浓硫酸敞口放置一段时间,溶质的质 量分数有何变化为什么?思考 2. 浓硫酸稀释应如何操作?思考 3. 不小心把浓硫酸沾到皮肤上应如何处理? 都减小,浓盐酸是由于溶质挥发,浓硫酸是因为有吸水性。 将浓硫酸沿烧杯壁缓慢加入盛有水的烧杯里,用玻璃棒不断搅动。 应立即用大量水冲洗,然后涂上 3%--5% 的NaHCO3 溶液。2 、酸的化学性质⑴ 酸具有相似化学性质的原因是酸的水溶液中都含有 ,都与酸碱指示剂作用。H+⑵ 、金属 + 酸 → 盐 + 氢气:(置换反应)Mg + 2HCl = MgCl2 + H2↑ Mg + H2SO4 = MgSO4 + H2↑Zn + 2HCl = ZnCl2 + H2↑ Zn + H2SO4 = ZnSO4 + H2↑Fe + 2HCl = FeCl2 + H2↑ Fe + H2SO4 = FeSO4 + H2↑2Al + 6HCl = 2AlCl3 + 3H2↑ 2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑ 氢以前,铁二价,铝三价,浓硫、硝酸不放氢。⑶ 、金属氧化物 + 酸 → 盐 + 水: (复分解反应)CuO + 2HCl = CuCl2 + H2O CuO + H2SO4 = CuSO4 + H2OFe2O3 + 6HCl = 2FeCl3 + 3H2O Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O Ag2O + 2HNO3 = 2AgNO3 + H2O MgO + 2HCl = MgCl2 + H2OZnO + H2SO4 = ZnSO4 + H2O Al2O3 + 6HCl = 2AlCl3 + 3H2O配平时抓住酸中H 和氧化物中 O的比例为 2 ︰ 1 。⑷ 、与碱反应: (复分解反应)KOH + HCl = KCl + H2O 2NaOH + H2SO4 = Na2SO4 + H2OCa(OH)2 + 2HCl = CaCl2 + 2H2O Al(OH)3 + 3HCl = AlCl3 + 3H2OH2SO4 + Ba(OH)2 = BaSO4↓ + 2H2OCu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O Mg(OH)2 + 2CH3COOH = (CH3COO)2Mg + 2H2O 中和反应的实质: H+ + OH- = H2O原子团多于 1 个才用括号!⑸ 、酸与盐...