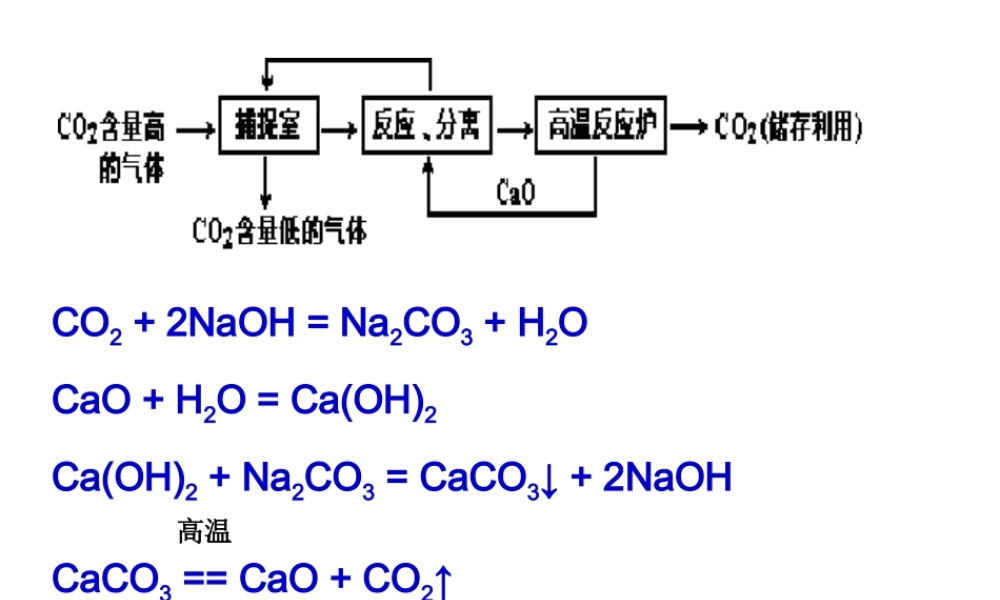
CO2 + 2NaOH = Na2CO3 + H2O CaO + H2O = Ca(OH)2 Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOHCaCO3 == CaO + CO2↑高温 请从“构成物质微粒”的角度对下列物质进行分类:氢气、金刚石、氯化镁、水、铝、氯化钠、铁、二氧化碳、碳酸钠。① 由原子构成的物质: ;② ;③ 。 金刚石、铝、铁由分子构成的物质:氢气、水、二氧化碳由离子构成的物质:氯化镁、氯化钠、碳酸钠总结:1 、由原子直接构成的物质有: 、 和 。2 、由分子构成的物质有: 、 、 和大多数 。3 、由离子构成的物质有: 、 和 。金属某些固体非金属单质稀有气体气态非金属单质(稀有气体除外)非金属氧化物酸有机物强碱盐活泼金属的氧化物含金属元素的化合物一般由离子构成!分子离子单质化合物2H2 + O2 == 2H2O2×2 32 2×18CO + CuO = Cu + CO2H2 + CuO = Cu + H2OFGHDECaCO3 + 2HCl == CaCl2 + CO2↑ + H2OCa(OH)2 + 2HCl == CaCl2 + 2H2O74 2×36.5X 25g×29.2%X=7.4g%7.60%1002.124.7gg第 18 讲物质的化学变化和反应类型一、物质的变化物理变化化学变化概念外观特征举例本质区别联系没有新物质生成的变化有新物质生成的变化状态、形状、大小的改变发光、放热、变色、生成气体、沉淀三态变化、物体破碎、电灯发光、吸附、蒸馏燃烧、生锈、变质、光合作用、干馏等分子的种类有无变化化学变化往往伴随物理变化,在物理变化中不一定发生化学变化化学变化常伴随能量变化1 、放热反应:2 、吸热反应:燃烧、缓慢氧化、中和、生石灰与水金属与酸等需要持续加热的一些反应如:碳与 CO2、碳与氧化铜、 CO 还原氧化铁等二、物理性质和化学性质物理性质化学性质概念内容相同点不需要通过化学变化所表现出来的性质物质在化学变化中所表现出来的性质色、态、味、硬密度、熔沸点、溶解性、导电导热性、吸附性、延展性等稳定性、可燃性、氧化性、还原性、酸碱性、毒性等都是物质的固有属性性质与变化的关系性质是物质的固有属性,是物质的基本特征;是变化的内因(即变化的依据)。变化只是一个过程,是性质的体现。物质的变化和性质在描述上的区别:描述物质的性质时常带“可以、能、会、易、难”等字词。性质与用途的关系性质决定用途,用途体现性质。浓硫酸的吸水性活性炭的吸附性氮气的稳定性焦炭的还原性熟石灰的碱性碳酸钠溶液的碱性三、对催化剂的理解1 、催化剂能改变物质的反应速率,但改变不一...