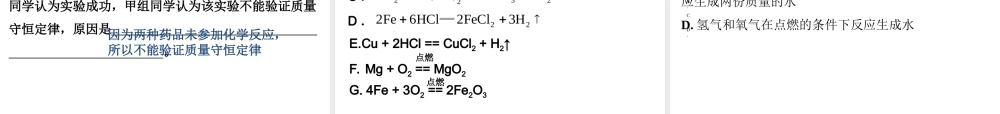第 19 讲 质量守恒定律和化学方程式一、质量守恒定律1 、定义:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。注意: ⑴ 只对化学变化有意义;⑵ 只适合于质量守恒和元素守恒,不是体积守恒,也不是分子数守恒;⑶ 不能把参加反应的各物质理解为反应物(可能有剩余);⑷ 生成物的质量包括气体和沉淀的质量。2 、微观解释: 化学反应的过程就是参加反应的各物质的原子重新组合而生成分子的过程。在一切化学反应中,反应前后原子的种类不变,质量不变,数目也不变。3 、化学反应中的变和不变⑴ 一定不变:宏观: 物质的总质量,元素的种类和质量。微观: 原子的种类、数目和质量不变。⑵ 一定改变:宏观: 物质的种类一定改变;微观: 分子的种类一定改变。⑶ 可能改变:分子的数目,元素的化合价可能改变。4 、探究实验设计基本原则:有气体参加或生成的反应,容器必 须密闭,反应过程中不能与外界有 物质交换。 关键点:橡皮塞必须塞紧,反应后冷却到室 温再称量。避免容器体积变化引起 的浮力的影响。5 、应用:配平化学方程式;推理反应物和生成物的组成或成分;进行一些有关反应物和生成物方面的计算。二、化学方程式1 、定义:用化学式来表示化学反应的式子。2 、意义:质的方面:表示反应物、生成物和反应条件;量的方面:宏观:反应物、生成物各物质的质量比;微观:反应物、生成物各物质的微粒个数比。气体反应物和气体生成物间的体积比。化学计量数与相对分子质量的乘积之比化学计量数之比3 、书写原则: 一要以客观事实为基础,二要遵守质量守恒定律。4 、读法:(以 C + O2 == CO2 为例)点燃宏观:在点燃的条件下,碳和氧气反应生成二 氧化碳;微观:在点燃的条件下,一个碳原子和一个氧 气分子反应生成一个二氧化碳分子;量的方面:每 12 份质量的 C 和 32 份质量的O2 完 全反应生成 44 份质量的CO2 。12 32 445 、书写步骤:写、配、等、标、查⑴ 反应物、生成物的化学式分居左右,中间为 横线;⑵ 配平:各物质化学式前加化学计量数( 1 则 省略),使两边同种原子的个数均相 等,横线改为等号;⑶ 标明反应条件和气体、沉淀符号;若反应物中有气体和固体,则不用标箭头。⑷ 检查6 、配平方法:遵守质量守恒定律⑴ 最小公倍数法:( ) H2 + ( ) N2 == ( ) NH3( ) P + ( ) O2 == ( ) P2O5321524归纳:用于某种...