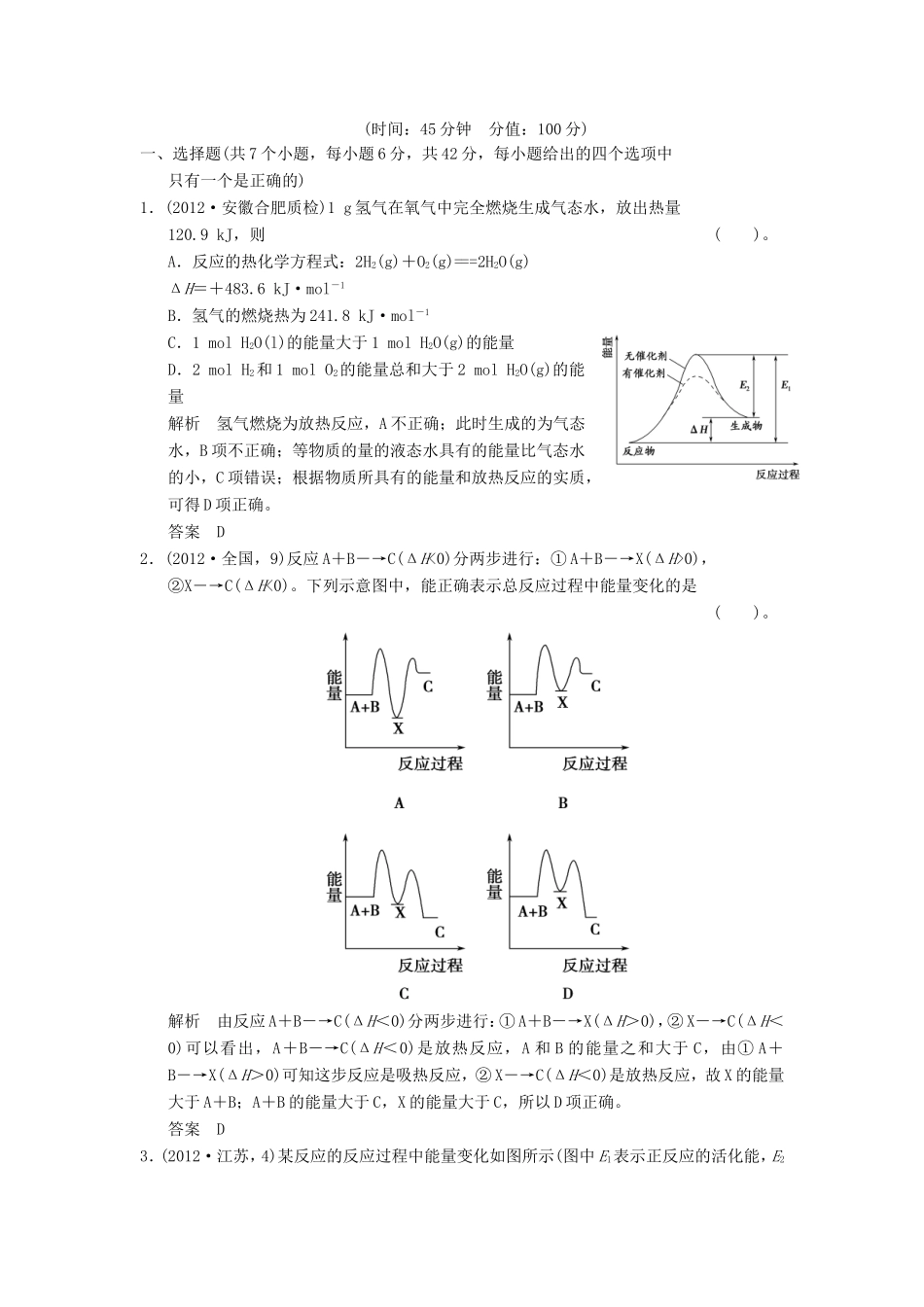
(时间:45分钟分值:100分)一、选择题(共7个小题,每小题6分,共42分,每小题给出的四个选项中只有一个是正确的)1.(2012·安徽合肥质检)1g氢气在氧气中完全燃烧生成气态水,放出热量120.9kJ,则()。A.反应的热化学方程式:2H2(g)+O2(g)===2H2O(g)ΔH=+483.6kJ·mol-1B.氢气的燃烧热为241.8kJ·mol-1C.1molH2O(l)的能量大于1molH2O(g)的能量D.2molH2和1molO2的能量总和大于2molH2O(g)的能量解析氢气燃烧为放热反应,A不正确;此时生成的为气态水,B项不正确;等物质的量的液态水具有的能量比气态水的小,C项错误;根据物质所具有的能量和放热反应的实质,可得D项正确。答案D2.(2012·全国,9)反应A+B―→C(ΔH<0)分两步进行:①A+B―→X(ΔH>0),②X―→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是()。解析由反应A+B―→C(ΔH<0)分两步进行:①A+B―→X(ΔH>0),②X―→C(ΔH<0)可以看出,A+B―→C(ΔH<0)是放热反应,A和B的能量之和大于C,由①A+B―→X(ΔH>0)可知这步反应是吸热反应,②X―→C(ΔH<0)是放热反应,故X的能量大于A+B;A+B的能量大于C,X的能量大于C,所以D项正确。答案D3.(2012·江苏,4)某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是()。A.该反应为放热反应B.催化剂能改变该反应的焓变C.催化剂能降低该反应的活化能D.逆反应的活化能大于正反应的活化能解析由图示可以看出生成物的总能量大于反应物的总能量,属于吸热反应,A项错误;焓变是指反应物与生成物之间的能量差值,与反应过程无关,B项错误;加入催化剂,改变了反应历程,E2变小,反应活化能减小,C项正确;正反应活化能大于逆反应活化能,D项错误。答案C4.(2012·马鞍山二模)25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是ΔH=-393.5kJ·mol-1、ΔH=-285.8kJ·mol-1、ΔH=-890.3kJ·mol-1、ΔH=-2800kJ·mol-1,则下列热化学方程式正确的是()。A.C(s)+O2(g)===CO(g)ΔH=-393.5kJ·mol-1B.2H2(g)+O2(g)===2H2O(l)ΔH=-571.6kJ·mol-1C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-890.3kJ·mol-1D.C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(g)ΔH=-1400kJ·mol-1解析根据燃烧热的含义得出:A项中生成物应是CO2;C、D项H2O中为液态;B项正确。答案B5.(2012·上海,9)工业生产水煤气的反应为:C(s)+H2O(g)―→CO(g)+H2(g)-131.4kJ,下列判断正确的是()。A.反应物能量总和大于生成物能量总和B.CO(g)+H2(g)―→C(s)+H2O(l)+131.4kJC.水煤气反应中生成1molH2(g)吸收131.4kJ热量D.水煤气反应中生成1体积CO(g)吸收131.4kJ热量解析本题意在考查考生对概念的理解。由题中信息知合成水煤气反应为吸热反应,故可判知反应物总能量小于生成物总能量,A项错;根据盖斯定律,将热化学方程式的两边同时乘以-1,得CO(g)+H2(g)―→C(s)+H2O(g)+131.4kJ,而B项中H2O为液态,故B项错;由题干化学方程式可知生成1molH2时需吸收131.4kJ的热量,C项正确;而D项中应为生成1molCO(g),D项错。答案C6.(2012·北京东城模拟)下列说法正确的是()。A.任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同B.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件的ΔH相同C.已知:①2H2(g)+O2(g)===2H2O(g)ΔH=-akJ·mol-1,②2H2(g)+O2(g)===2H2O(l)ΔH=-bkJ·mol·-1,则a>bD.已知:①C(s,石墨)+O2(g)===CO2(g)ΔH=-393.5kJ·mol·-1,②C(s,金刚石)+O2(g)===CO2(g)ΔH=-395.0kJ·mol·-1,则C(s,石墨)===C(s,金刚石)ΔH=+1.5kJ·mol-1解析浓酸、弱酸等发生酸碱中和时中和热不同,A项错误;反应热只与反应物和生成物具有的能量有关,与反应的条件无关,B项正确;生成液态水放出的热量更多,故-b<-a,即b>a,C项错误;利用盖斯定律得:①-②,即可求算出,D项正确。答案BD7.(2012·皖中六校联考)已知断开或形成1mol化学键吸收或放出的能量称为化学键的键能,如H—H键的键能为436kJ·mol-1,N≡N键的键能为945kJ·mol-1,N—H键的键...