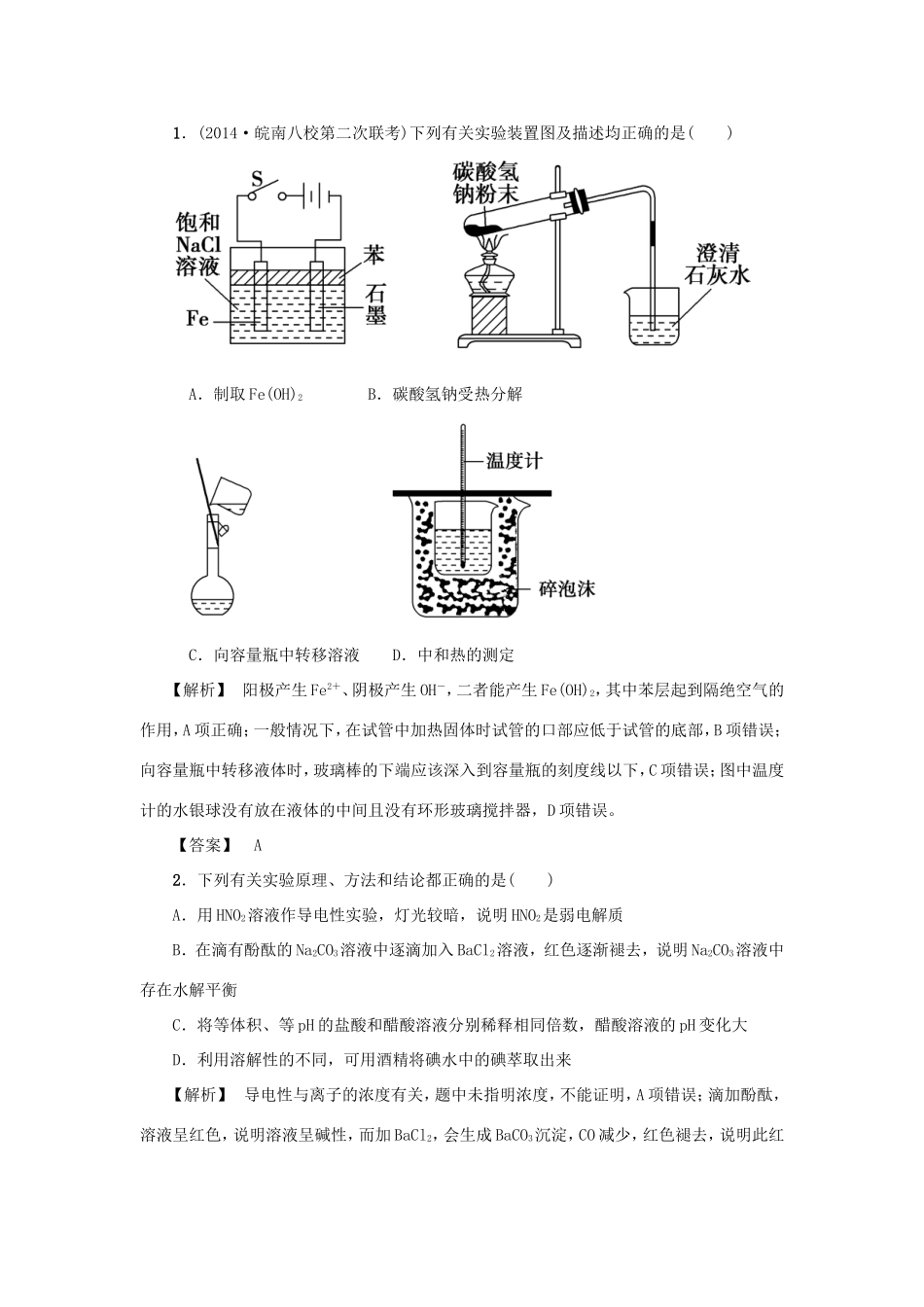
1.(2014·皖南八校第二次联考)下列有关实验装置图及描述均正确的是()A.制取Fe(OH)2B.碳酸氢钠受热分解C.向容量瓶中转移溶液D.中和热的测定【解析】阳极产生Fe2+、阴极产生OH-,二者能产生Fe(OH)2,其中苯层起到隔绝空气的作用,A项正确;一般情况下,在试管中加热固体时试管的口部应低于试管的底部,B项错误;向容量瓶中转移液体时,玻璃棒的下端应该深入到容量瓶的刻度线以下,C项错误;图中温度计的水银球没有放在液体的中间且没有环形玻璃搅拌器,D项错误。【答案】A2.下列有关实验原理、方法和结论都正确的是()A.用HNO2溶液作导电性实验,灯光较暗,说明HNO2是弱电解质B.在滴有酚酞的Na2CO3溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡C.将等体积、等pH的盐酸和醋酸溶液分别稀释相同倍数,醋酸溶液的pH变化大D.利用溶解性的不同,可用酒精将碘水中的碘萃取出来【解析】导电性与离子的浓度有关,题中未指明浓度,不能证明,A项错误;滴加酚酞,溶液呈红色,说明溶液呈碱性,而加BaCl2,会生成BaCO3沉淀,CO减少,红色褪去,说明此红色是由CO水解引起的,B项正确;醋酸是弱酸,不完全电离,在稀释过程中又会电离,故其pH变化小,C项错误;酒精与水互溶,不能萃取,D项错误。【答案】BB组高考题组3.(双选)(2013·广东高考)下列实验的现象与对应结论均正确的是()选项操作现象结论A将浓硫酸滴到蔗糖表面固体变黑膨胀浓硫酸有脱水性和强氧化性B常温下将Al片放入浓硝酸中无明显现象Al与浓硝酸不反应C将一小块Na放入无水乙醇中产生气泡Na能置换出醇羟基中的氢D将水蒸气通过灼热的铁粉粉末变红铁与水在高温下发生反应【解析】A项,将浓硫酸滴到蔗糖表面,浓硫酸将蔗糖中的氢、氧原子按水中氢、氧原子个数比2∶1脱去,并且与C反应产生CO2、SO2等气体,浓硫酸体现脱水性和强氧化性;B项,常温下将Al片放入浓硝酸中,无明显现象,是因为Al遇到浓硝酸发生钝化,该钝化过程中包含化学反应;C项,钠放入无水乙醇中,发生置换反应,产生H2;D项,水蒸气与灼热的铁粉发生反应生成Fe3O4和H2,Fe3O4粉末呈黑色。【答案】AC4.(2011·江苏高考)下列有关实验原理、方法和结论都正确的是()A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体B.取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中的少量苯酚D.已知II2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大【解析】A项中向饱和FeCl3溶液中滴加过量氨水会生成氢氧化铁沉淀,得不到胶体;B项中应先滴加KSCN溶液,没有现象,排除Fe3+的干扰,再加氯水,若溶液变红,说明有Fe2+;C项中苯酚和氢氧化钠反应生成可溶性的苯酚钠,再通过分液把苯分离出来;D项说明I2的溶解度在CCl4中比在水中的大,而不是KI3。【答案】C5.(2013·新课标全国卷Ⅰ)锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-===LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。回答下列问题:(1)LiCoO2中,Co元素的化合价为________。(2)写出“正极碱浸”中发生反应的离子方程式________________。(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式_______;可用盐酸代替H2SO4和H2O2的混合液,但缺点是________。(4)写出“沉钴”过程中发生反应的化学方程式__________________________。(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式___________________。(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是______________________。在整个回收工艺中,可回收到的金属化合物有________________(填化学式)。【解析】(1)LiCO2中Li为+1价,O为-2价,故Co元素的化合价为+3价。(2)正极碱浸过程中,导电剂中Al箔与NaOH溶液...