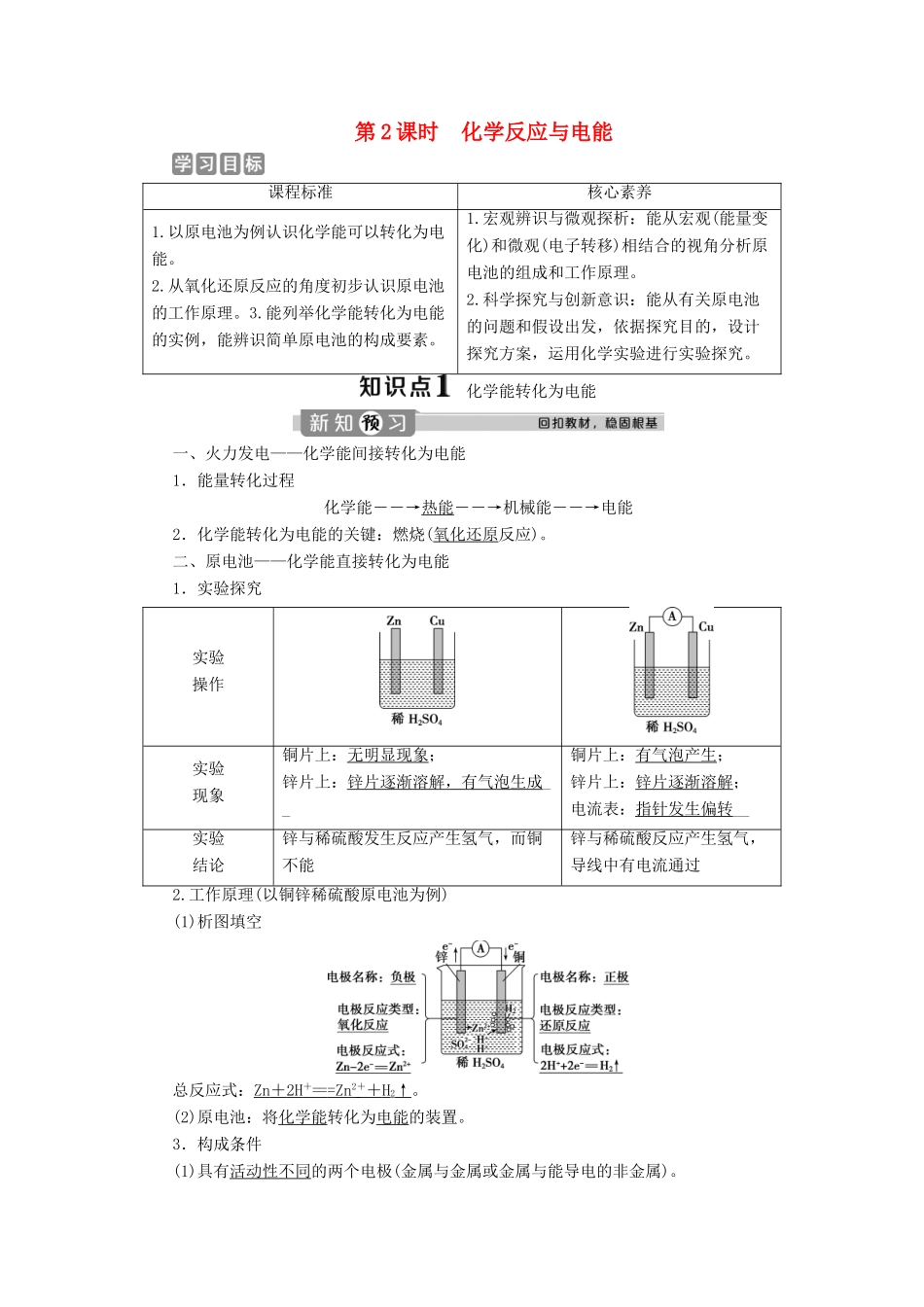
第2课时化学反应与电能课程标准核心素养1.以原电池为例认识化学能可以转化为电能。2.从氧化还原反应的角度初步认识原电池的工作原理。3.能列举化学能转化为电能的实例,能辨识简单原电池的构成要素。1.宏观辨识与微观探析:能从宏观(能量变化)和微观(电子转移)相结合的视角分析原电池的组成和工作原理。2.科学探究与创新意识:能从有关原电池的问题和假设出发,依据探究目的,设计探究方案,运用化学实验进行实验探究。化学能转化为电能一、火力发电——化学能间接转化为电能1.能量转化过程化学能――→热能――→机械能――→电能2.化学能转化为电能的关键:燃烧(氧化还原反应)。二、原电池——化学能直接转化为电能1.实验探究实验操作实验现象铜片上:无明显现象;锌片上:锌片逐渐溶解,有气泡生成__铜片上:有气泡产生;锌片上:锌片逐渐溶解;电流表:指针发生偏转__实验结论锌与稀硫酸发生反应产生氢气,而铜不能锌与稀硫酸反应产生氢气,导线中有电流通过2.工作原理(以铜锌稀硫酸原电池为例)(1)析图填空总反应式:Zn+2H+===Zn2++H2↑。(2)原电池:将化学能转化为电能的装置。3.构成条件(1)具有活动性不同的两个电极(金属与金属或金属与能导电的非金属)。(2)溶液:两电极均插入电解质溶液中。(3)导线:两电极用导线相连,形成闭合回路。1.多角度判断原电池的正、负极2.原电池原理的应用(1)比较金属活动性原电池中,做负极的金属活动性一般比做正极的金属活动性强。(2)改变化学反应速率如在Zn和稀硫酸反应时,滴加少量CuSO4溶液,则Zn置换出的铜和锌构成原电池的正负极,从而加快Zn与稀硫酸反应的速率。(3)设计原电池如把Fe+2Fe3+===3Fe2+设计成原电池,可用Fe做负极,石墨做正极,FeCl3溶液做电解质溶液。1.下面是有关各种形式能量的相互转化途径的叙述,其中错误的是()A.家庭液化气灶将化学能转变为热能B.灯泡将电能全部转变为光能C.光合作用将光能转变为化学能D.太阳能电池将太阳能转变为电能解析:选B。灯泡除了将电能转变为光能之外,还转变为热能等其他形式的能量。2.如图为某兴趣小组制作的番茄电池,下列说法正确的是()A.电子由铜电极通过导线流向锌电极B.该装置是将电能转化为化学能的装置C.锌电极发生氧化反应D.电流由锌电极通过导线流向铜电极解析:选C。A项,铜做正极,锌做负极,因此电子由锌电极通过导线流向铜电极,故错误;B项,该装置将化学能转化为电能,故错误;C项,锌做负极失去电子,发生氧化反应,故正确;D项,电子流向与电流的方向相反,因此电流由铜电极通过导线流向锌电极,故错误。3.如图所示各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)()解析:选D。原电池的形成条件包括活动性不同的电极、电解质溶液、形成闭合回路、自发进行氧化还原反应。对图示各个装置进行观察,发现只有D项不能形成闭合回路,因此D项不能形成原电池。化学电池1.锌锰干电池——一次电池(1)构造示意图(2)特点:放电之后不能充电。2.充电电池——二次电池(1)特点:放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。(2)实例:铅酸蓄电池、镍氢电池、锂离子电池等。3.燃料电池(1)概念:将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置。(2)特点:①清洁、安全、高效;②反应物不是储存在电池内部,而是由外部提供;③供电量易于调节,能适应用电器负载的变化,且充电时间较短。1.下列几种化学电池中,不属于可充电电池的是()A.碱性锌锰电池B.手机用锂离子电池C.汽车用铅酸蓄电池D.玩具用镍氢电池解析:选A。A项,碱性锌锰电池属于一次电池,不属于可充电电池,正确;B项,手机用锂离子电池属于可充电电池,错误;C项,汽车用铅酸蓄电池属于可充电电池,错误;D项,玩具用镍氢电池属于可充电电池,错误。2.下列有关锌锰干电池的说法中正确的是()A.锌筒是负极,石墨棒是正极B.在外电路中电子从石墨棒流向锌筒C.电流从锌筒流向石墨棒D.在电池内部阳离子从石墨棒向锌筒移动解析:选A。A项,在锌锰干电池中,锌筒是负极,石墨棒是正极,故正确;B项,在外电路中...