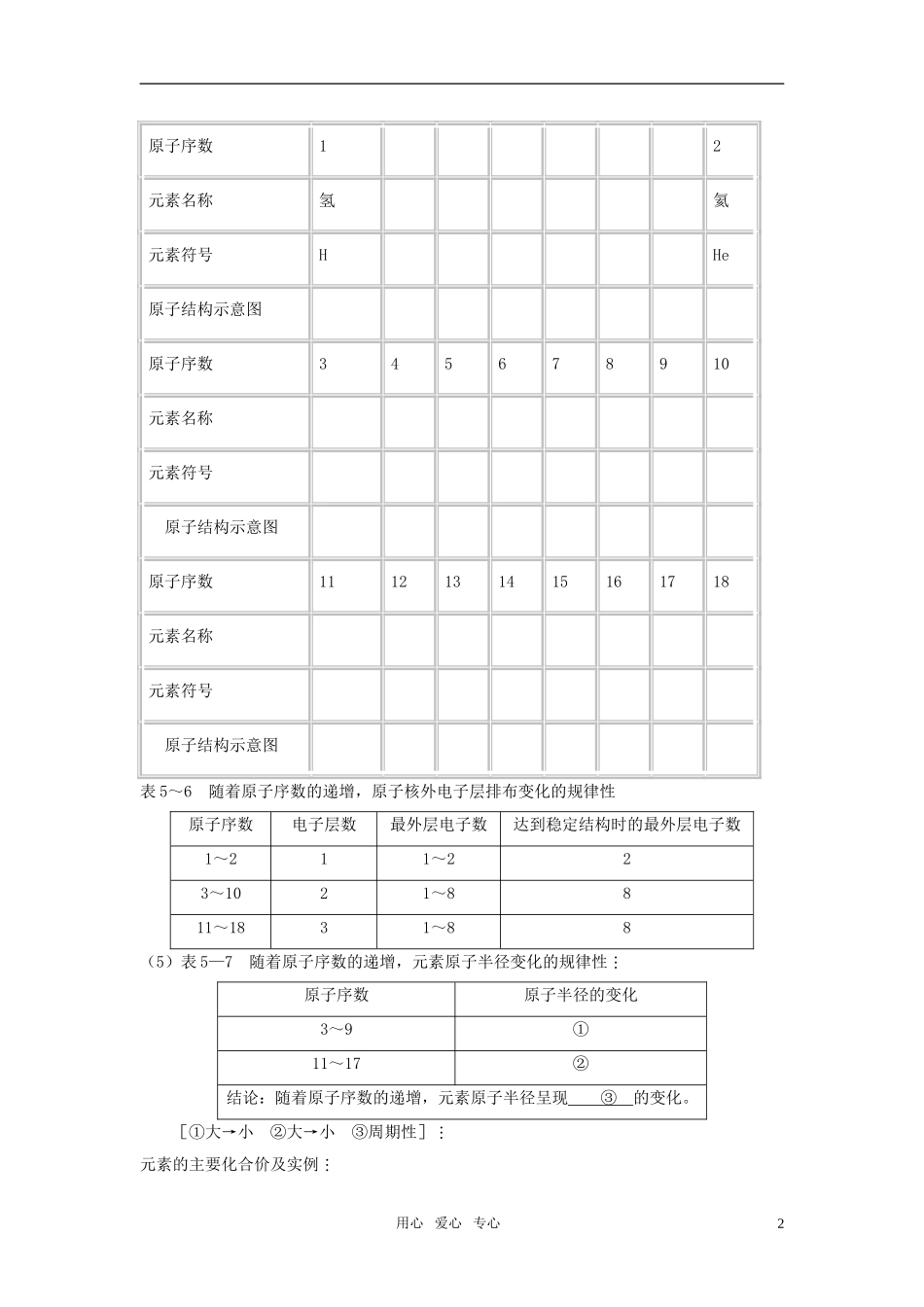
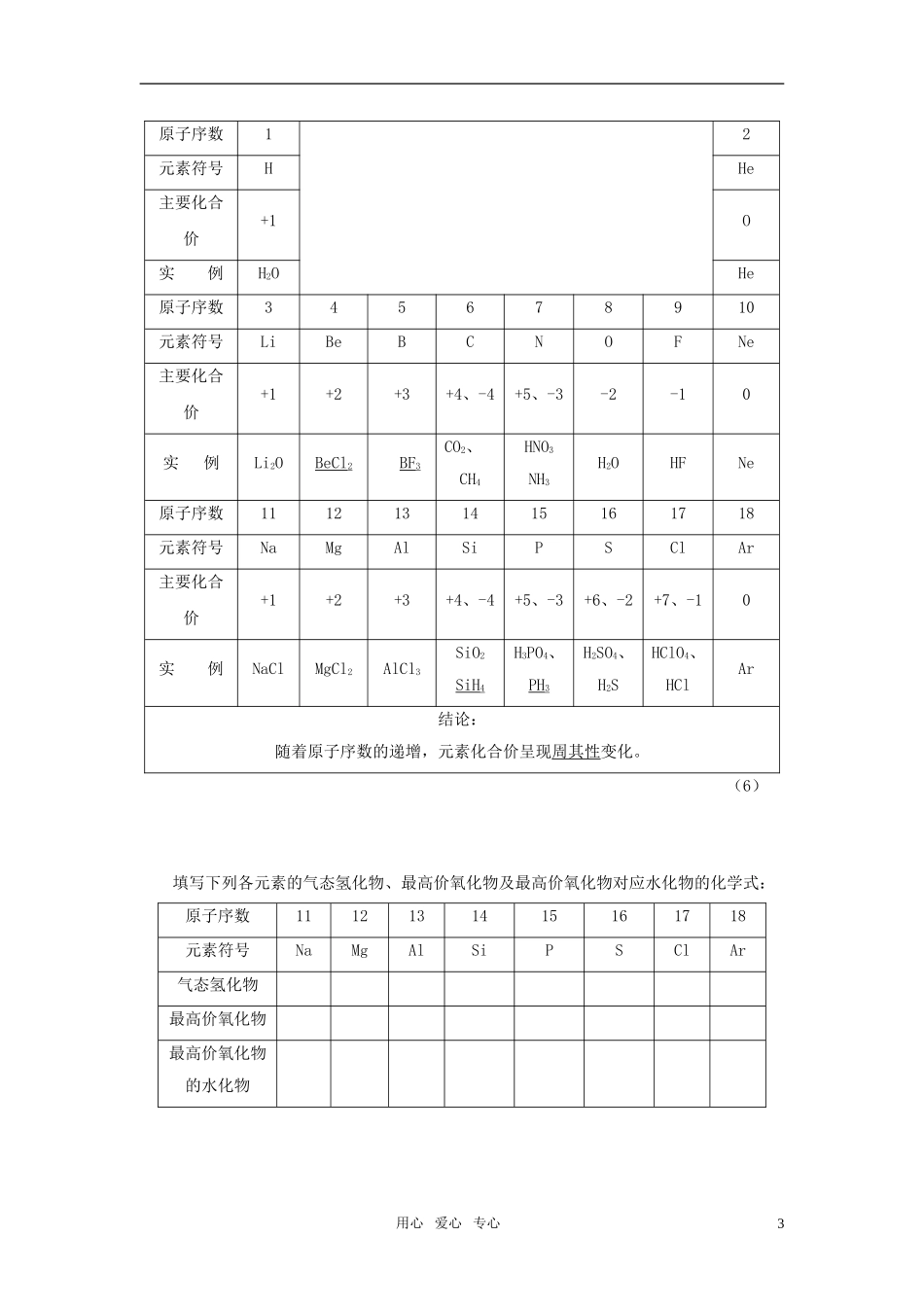
第二节元素周期律知识与技能:1、使学生了解元素原子核外电子排布、原子半径、主要化合价与元素金属性、元素非金属性的周期性变化。2、了解两性氧化物和两性氢氧化物的概念。3、认识元素性质的周期性变化是元素原子核外电子排布周期性变化的结果,从而理解元素周期律的实质。4、通过教学,培养学生的逻辑推理能力。过程与方法:1、归纳法、比较法2、培养学生抽象思维能力情感态度价值观:培养学生勤于思考、勇于探究的科学品质。教学重点:原子的核外电子层排布和元素金属性、非金属性变化的规律。教学难点:元素金属性、非金属性变化的规律。教学过程:第1课时设问:碱金属元素间、卤族元素间的化学性质为什么相似?结论:结构决定性质,(性质决定用途)。讲述:目前已发现了100多种元素,它们的结构与性质各有什么联系?这其中有没有什么规律?(引出板书)目前已经发现和合成的115种元素在排列时,也是按一定规律排列的,也有一定的周期,那么,这里面周期是什么?有哪些规律可言?建立原子序数概念后让学生阅读:表5-5、图5-5,解决以下问题:1:原子序数概念:。①随着原子序数的递增,元素的种类呈现怎样的规律性的变化?②随着原子序数递增,原子最外层电子排布呈现怎样规律性变化?③随着原子序数递增,元素原子半径呈现怎样的规律性变化?④随着原子序数递增,元素主要化合价呈现怎样的规律性变化?板书:原子序数=核电荷数=质子数=原子核外电子数填表:用心爱心专心1原子序数12元素名称氢氦元素符号HHe原子结构示意图原子序数345678910元素名称元素符号原子结构示意图原子序数1112131415161718元素名称元素符号原子结构示意图表5~6随着原子序数的递增,原子核外电子层排布变化的规律性原子序数电子层数最外层电子数达到稳定结构时的最外层电子数1~211~223~1021~8811~1831~88(5)表5—7随着原子序数的递增,元素原子半径变化的规律性原子序数原子半径的变化3~9①11~17②结论:随着原子序数的递增,元素原子半径呈现③的变化。[①大→小②大→小③周期性]元素的主要化合价及实例用心爱心专心2原子序数12元素符号HHe主要化合价+1O实例H2OHe原子序数345678910元素符号LiBeBCNOFNe主要化合价+1+2+3+4、-4+5、-3-2-10实例Li2OBeCl2BF3CO2、CH4HNO3NH3H2OHFNe原子序数1112131415161718元素符号NaMgAlSiPSClAr主要化合价+1+2+3+4、-4+5、-3+6、-2+7、-10实例NaClMgCl2AlCl3SiO2SiH4H3PO4、PH3H2SO4、H2SHClO4、HClAr结论:随着原子序数的递增,元素化合价呈现周其性变化。(6)填写下列各元素的气态氢化物、最高价氧化物及最高价氧化物对应水化物的化学式:原子序数1112131415161718元素符号NaMgAlSiPSClAr气态氢化物最高价氧化物最高价氧化物的水化物用心爱心专心3分析:周期性变化的起点、终点的一致性,并分析主要化合价中正价与负价的关系,还要从原子半径最大的原子同时又是最外层电子数最少的,表现最强的金属性,同理,原子半径最小的原子又是最外层电子数最多的,表现最强的非金属性。再根据原子半径与最外层电子数的变化引出元素金属性与非金属性周期性变化规律。结论:1.随着原子序数的递增,元素种类、元素原子最外层电子排布、元素原子半径、元素的主要化合价、元素的金属性与非金属性都呈现周期性变化。2.元素性质(原子半径、主要化合价、元素的金属性与非金属性)呈现周期性变化的规律,叫元素周期律。3.元素性质周期性变化是原子核外电子排布周期性变化必然结果。新课的延伸:1.所隔的元素数目是不是相同?所呈现的周期是否规则?2.每一个变化周期与元素周期表中的横行有什么关系?教学小结:1.原子序数、元素周期律的概念。2.元素性质周期性变化的表现形式及与最外层电子排布周期性变化的关系第二课时新课准备:提问:⑴原子序数、元素同期律的概念;⑵元素性质同期性变化的形式。设问:元素的金属性、非金属性是否也随着原子序数的递增呈现同期性变化?新课进行:讲述:“越易越强、越强越强”即:⑴金属:与水或酸反应越容易,金属性越强;最高价氧化物对应的水化物(氢氧化物)碱性越强,金属性越强。⑵非金属性:与氢气化合越容易,非...