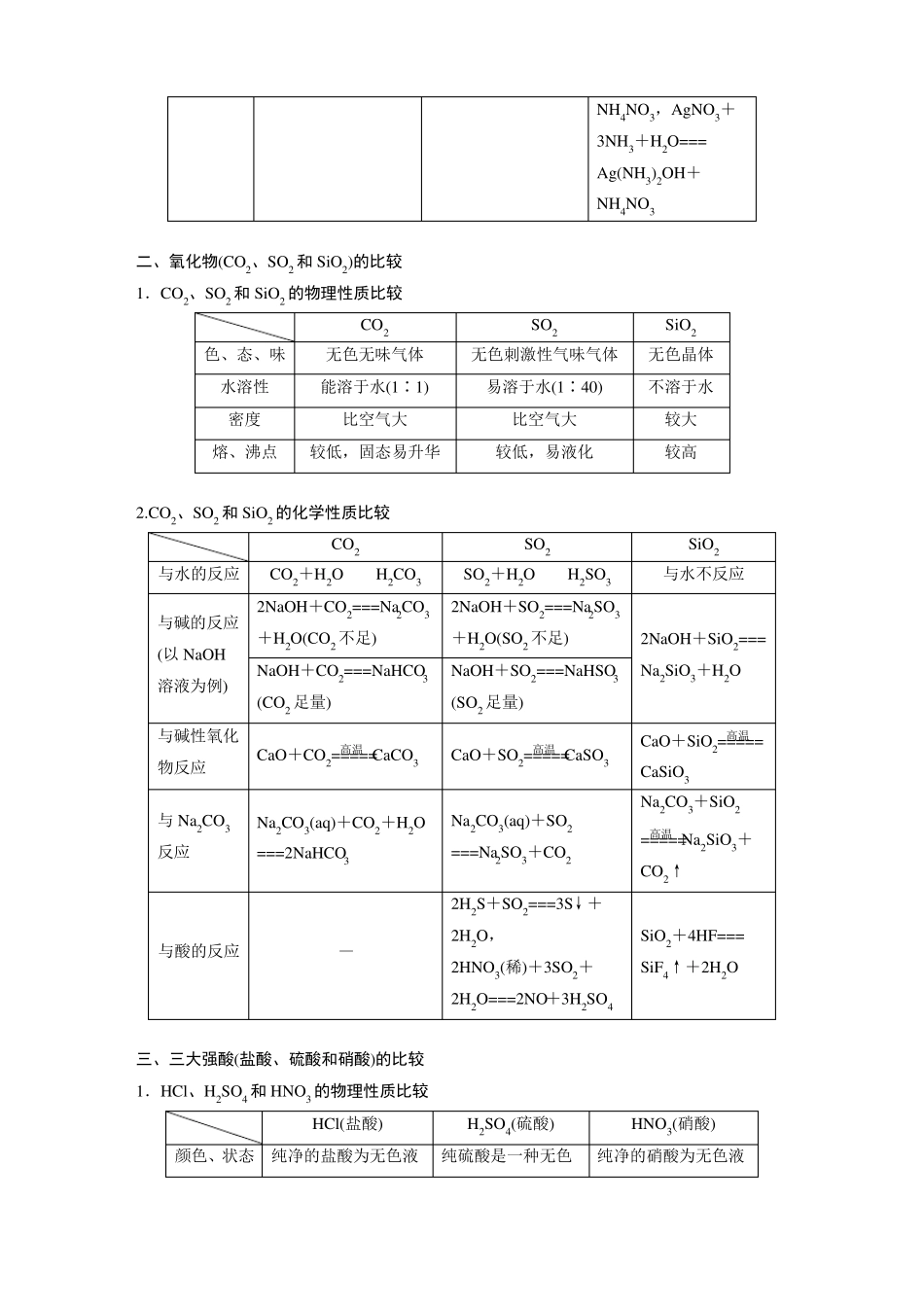
几种重要的物质性质比较一、氢化物(HCl、H2S、NH3)的比较1.HCl、H2S和NH3的制取方法比较HCl利用食盐和浓硫酸在不加热或稍微加热的条件反应原理下,进行反应:NaCl+H2SO4(浓)=====NaHSO4+HCl↑反应装置收集方法尾气处理2.HCl、H2S和NH3的性质比较HCl水溶液显强酸性,与酸碱性碱反应生成盐和水,如NaOH+HCl===NaCl+H2O与活泼金属反应,表氧化性现氧化性,如Fe+2HCl===FeCl2+H2↑与强氧化剂(如MnO2、KClO3等)反还原性H2S水溶液显弱酸性,与碱反应生成盐和水,如2NaOH+H2S===Na2S+2H2O与较活泼金属反应,表现氧化性与较强的氧化剂(如O2、Cl2、SO2等)反应:与某些金属氧化物(氧化剂,如CuO等)反应:3CuO+2NH33Cu+N2+3H2O先生成白色沉淀,氨气过量时,沉淀溶解:AgNO3+NH3+H2O===AgOH↓+NH3水溶液显弱碱性,与酸反应生成盐,如NH3+HCl===NH4Cl固体+液体――→气体向上排空气法用水或碱溶液吸收△△H2S用硫化亚铁跟稀盐酸或稀硫酸反应:FeS+2HCl===FeCl2+H2S↑,FeS+H2SO4(稀)===FeSO4+H2S↑固体+液体―→气体向上排空气法用碱溶液吸收NH3用NH4Cl固体与消石灰混合加热:Ca(OH)2+2NH4Cl=====CaCl2+2NH3↑+2H2O固体+固体――→气体向下排空气法用稀酸溶液吸收△△-△应:MnO2+4HCl(浓)H2S+Cl2=====S↓+=====MnCl2+Cl2↑+2H2O生成白色沉淀:AgNO3+HCl===AgCl↓+HNO3△2HCl,2H2S+SO2===3S↓+2H2O生成黑色沉淀:2AgNO3+H2S===Ag2S↓+2HNO3与AgNO3溶液反应NH4NO3,AgNO3+3NH3+H2O===Ag(NH3)2OH+NH4NO3二、氧化物(CO2、SO2和SiO2)的比较1.CO2、SO2和SiO2的物理性质比较色、态、味水溶性密度熔、沸点2.CO2、SO2和SiO2的化学性质比较与水的反应与碱的反应(以NaOH溶液为例)与碱性氧化物反应与Na2CO3反应CO2CO2+H2OH2CO3SO2SO2+H2OH2SO3SiO2与水不反应CO2无色无味气体能溶于水(1∶1)比空气大较低,固态易升华SO2无色刺激性气味气体易溶于水(1∶40)比空气大较低,易液化SiO2无色晶体不溶于水较大较高2NaOH+CO2===Na2CO3+H2O(CO2不足)NaOH+CO2===NaHCO3(CO2足量)CaO+CO2=====CaCO3高温2NaOH+SO2===Na2SO3+H2O(SO2不足)NaOH+SO2===NaHSO3(SO2足量)CaO+SO2=====CaSO3高温2NaOH+SiO2===Na2SiO3+H2OCaO+SiO2=====CaSiO3Na2CO3+SiO2高温Na2CO3(aq)+CO2+H2O===2NaHCO3Na2CO3(aq)+SO2===Na2SO3+CO22H2S+SO2===3S↓+=====Na2SiO3+CO2↑高温与酸的反应—2H2O,2HNO3(稀)+3SO2+2H2O===2NO+3H2SO4SiO2+4HF===SiF4↑+2H2O三、三大强酸(盐酸、硫酸和硝酸)的比较1.HCl、H2SO4和HNO3的物理性质比较HCl(盐酸)H2SO4(硫酸)纯硫酸是一种无色HNO3(硝酸)纯净的硝酸为无色液颜色、状态纯净的盐酸为无色液体,常见的盐酸中因含有工业杂质(Fe3)而呈黄色水溶性挥发性2.HCl、H2SO4和HNO3的化学性质比较(1)不稳定性以任意比与水互溶易挥发,挥发出HCl气体+无味的油状液体体,常见浓硝酸因溶有分解产生的NO2而呈黄色以任意比与水互溶高沸点,难挥发以任意比与水互溶易挥发,挥发出HNO3气体浓硝酸具有不稳定性,见光或受热易发生分解,化学方程式为4HNO3(浓)=====4NO2↑+O2↑加热+2H2O,而盐酸、硫酸则不易分解。注意久置浓硝酸呈黄色,是因为溶解了HNO3分解生成的NO2。因此,实验室中存放浓硝酸时,应放在棕色试剂瓶中,并置于冷暗处。向变黄的浓硝酸中通入足量空气(或氧气)能使其变成无色,发生反应的化学方程式为4NO2+O2+2H2O===4HNO3。(2)强酸性盐酸、硫酸、硝酸均为强酸,具有酸的通性,能使酸碱指示剂变色,能与金属、碱、碱性氧化物、弱酸盐等发生反应。①与酸碱指示剂的显色反应盐酸、稀H2SO4、稀HNO3均能使紫色石蕊溶液显红色。注意浓HNO3具有强酸性和强氧化性,能使紫色石蕊溶液先显红色(表现强酸性)后退色(表现强氧化性、漂白性)。②与金属的反应盐酸、稀H2SO4与金属活动性顺序表中位于H之前的金属单质发生置换反应,反应通式:活泼金属+酸(盐酸或稀H2SO4)―→相应的盐+H2↑。例如:Zn+2HCl===ZnCl2+H2↑Fe+H2SO4===FeSO4+H2↑HNO3为氧化性酸,与金属活动性顺序表中除Pt、Au之外的金属都能发生氧化还原反应,HNO3中的氮元素被还原。其...