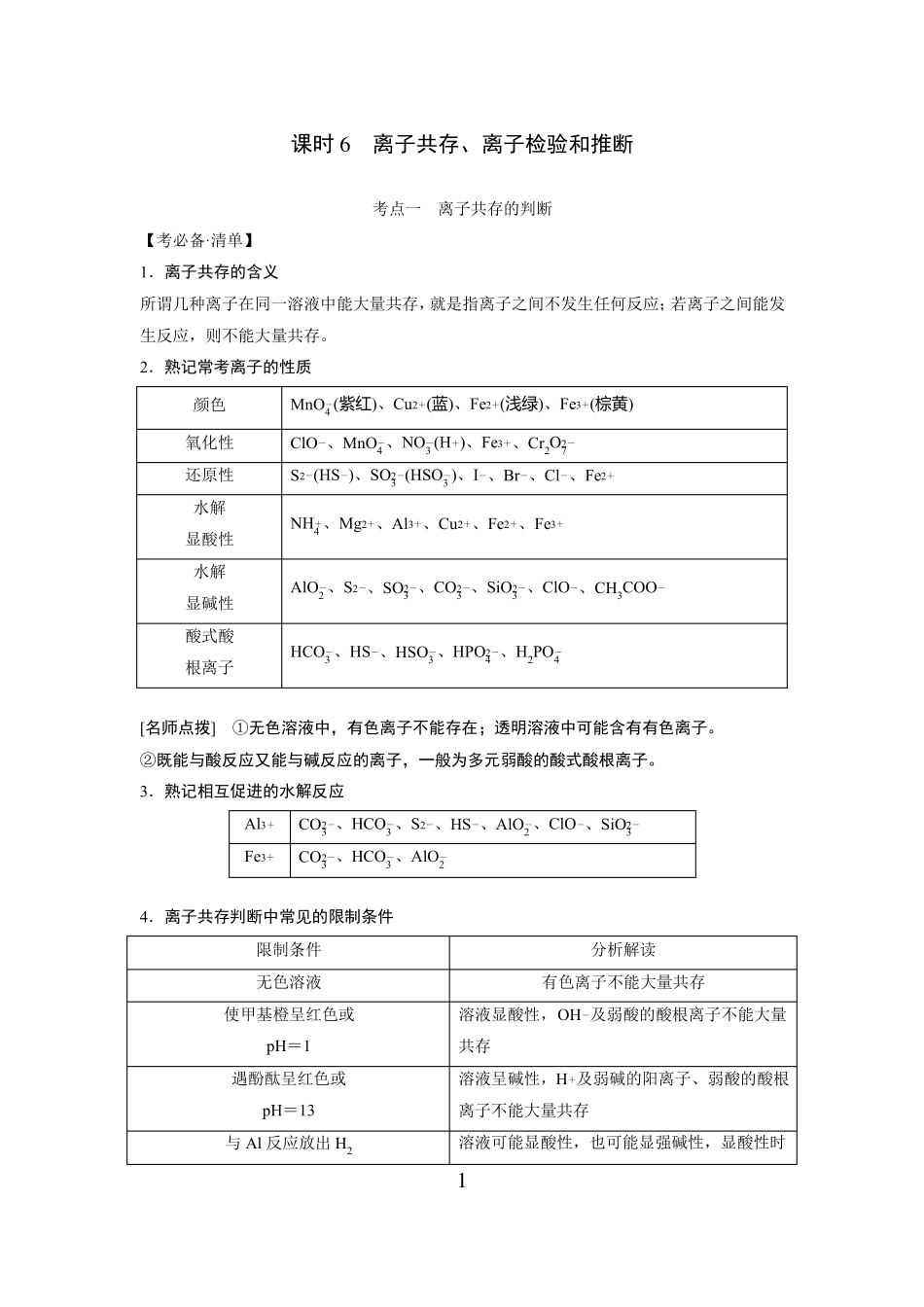
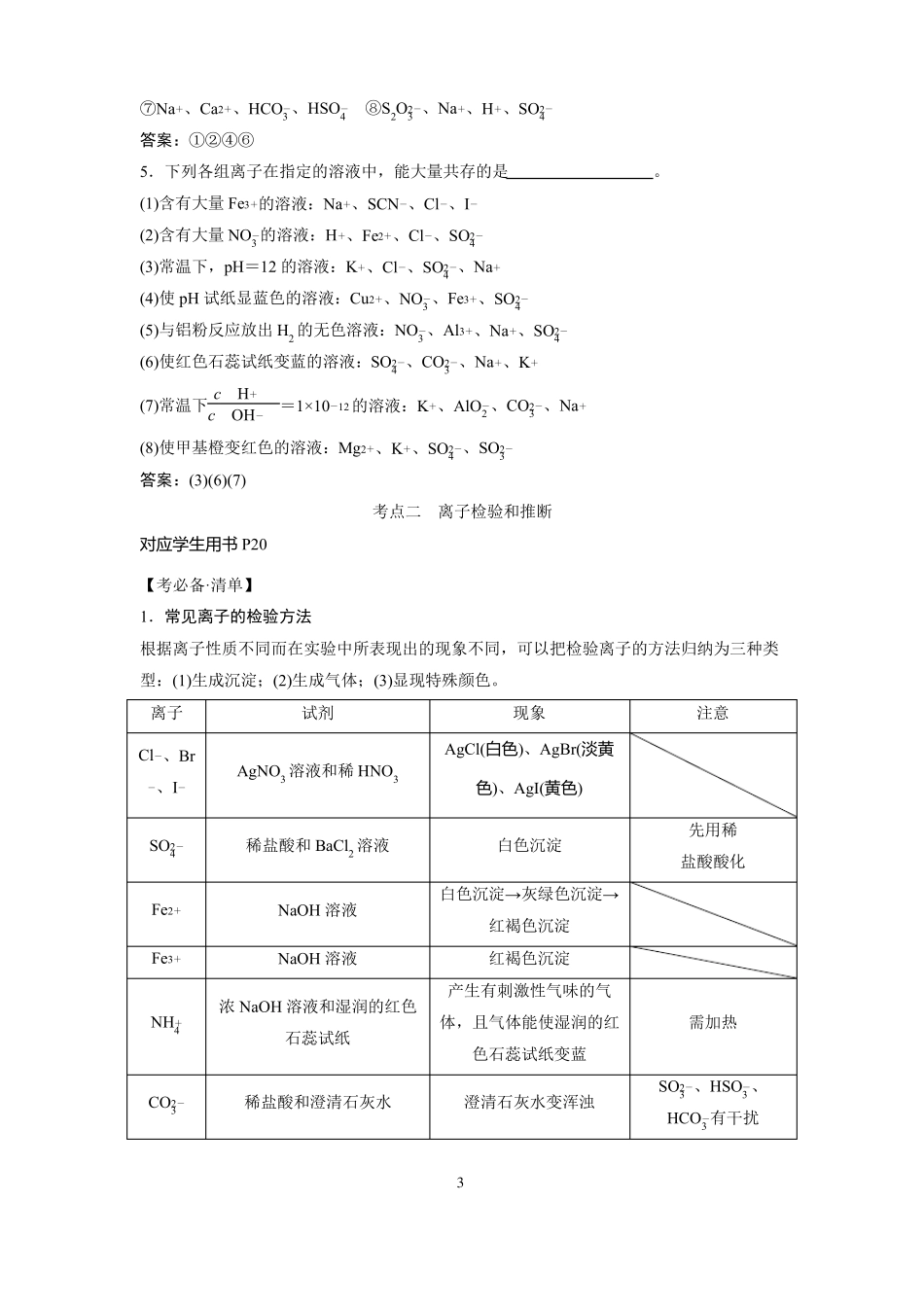
课时6离子共存、离子检验和推断考点一离子共存的判断【考必备·清单】1.离子共存的含义所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。2.熟记常考离子的性质颜色氧化性还原性水解显酸性水解显碱性酸式酸根离子[名师点拨]①无色溶液中,有色离子不能存在;透明溶液中可能含有有色离子。②既能与酸反应又能与碱反应的离子,一般为多元弱酸的酸式酸根离子。3.熟记相互促进的水解反应Al3Fe34.离子共存判断中常见的限制条件限制条件无色溶液使甲基橙呈红色或pH=1遇酚酞呈红色或pH=13与Al反应放出H2分析解读有色离子不能大量共存溶液显酸性,OH及弱酸的酸根离子不能大量共存溶液呈碱性,H及弱碱的阳离子、弱酸的酸根离子不能大量共存溶液可能显酸性,也可能显强碱性,显酸性时+-++MnO4(紫红)、Cu2(蓝)、Fe2(浅绿)、Fe3(棕黄)ClO、MnO4、NO3(H)、Fe3、Cr2O272S2(HS)、SO23(HSO3)、I、Br、Cl、Fe-------+---++--+++NH4、Mg2、Al3、Cu2、Fe2、Fe3++++++22AlO2、S2、SO23、CO3、SiO3、ClO、CH3COO-------HCO3、HS、HSO3、HPO24、H2PO4-----22CO23、HCO3、S、HS、AlO2、ClO、SiO3-------CO23、HCO3、AlO2---1不能含有NO3由水电离出的c(H)=1×10+-13-mol·L1-溶液可能显酸性,也可能显碱性溶液呈酸性(或碱性)能发生氧化还原反应的氧化性离子和还原性离子不能大量共存确定是“可能性”还是“肯定性”说明该溶液呈酸性[稀释的是溶质,溶质c(H)减小,而c(OH)增大]该溶液呈酸性-+通入足量的CO2(或NH3)因发生氧化还原反应而不能大量共存“一定”“可能”还是“不能”大量共存cH加水稀释,减小-cOHcH某溶液的lg=12-cOH【提素能·好题】1.判断正误(正确的打“√”,错误的打“×”)。++(1)透明的溶液即无色溶液,不含有任何有颜色的离子()(2)Fe3和Al3在中性溶液中能大量存在()(3)加入铝粉能够发生反应产生氢气的溶液,一定是酸性溶液()(4)水电离出c(H)=1×10++-13++mol·L-1的溶液呈碱性()+-(5)次氯酸能电离产生H,故在溶液中H和ClO能够大量共存()答案:(1)×(2)×(3)×(4)×(5)×2.下列各组离子在溶液中因发生复分解反应而不能大量共存的是。①K、H、CH3COO、Br②Ba2、Na、CO23、NO3③Na、HCO3、H、Cl④Al3、Fe3、NO3、SO24⑤Na、K、AlO2、NO3⑥Na、H、Cl、OH答案:①②③⑥3.下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是。①H3O、NO3、Fe2、Na②Na、Fe3、I、Cl22③H、S2、SO23、SO4④SO4、NO3、Na、H+-----+++-++++--++--++--+-+-++--++--++--⑤I、ClO、K、H⑥Na、K、MnO4、Cl答案:①②③⑤⑥4.下列各组离子在溶液中因水解相互促进而不能大量共存的是。①Al3、HCO3、Cl、K②Al3、SiO23、Na、Cl232③Fe3、NH4、SO24、S④Fe、Cl、Na、CO3++--+-+-+--++-+---++++--⑤Al3、Fe3、SCN、Cl⑥Na、Al3、NO3、AlO2++--++--22⑦Na、Ca2、HCO3、HSO4⑧S2O23、Na、H、SO4++---++-答案:①②④⑥5.下列各组离子在指定的溶液中,能大量共存的是。(1)含有大量Fe3的溶液:Na、SCN、Cl、I(2)含有大量NO3的溶液:H、Fe2、Cl、SO24(3)常温下,pH=12的溶液:K、Cl、SO24、Na(4)使pH试纸显蓝色的溶液:Cu2、NO3、Fe3、SO24(5)与铝粉反应放出H2的无色溶液:NO3、Al3、Na、SO242(6)使红色石蕊试纸变蓝的溶液:SO24、CO3、Na、K--++-++-+-+-+--+-++--++---cH-+--+(7)常温下=1×1012的溶液:K、AlO2、CO2-3、NacOH2(8)使甲基橙变红色的溶液:Mg2、K、SO24、SO3++--+答案:(3)(6)(7)考点二离子检验和推断对应学生用书P20【考必备·清单】1.常见离子的检验方法根据离子性质不同而在实验中所表现出的现象不同,可以把检验离子的方法归纳为三种类型:(1)生成沉淀;(2)生成气体;(3)显现特殊颜色。离子Cl、Br--试剂现象AgCl(白色)、AgBr(淡黄注意、I-AgNO3溶液和稀HNO3色)、AgI(黄色)白色沉淀白色沉淀→灰绿色沉淀→红褐色沉淀红褐色...