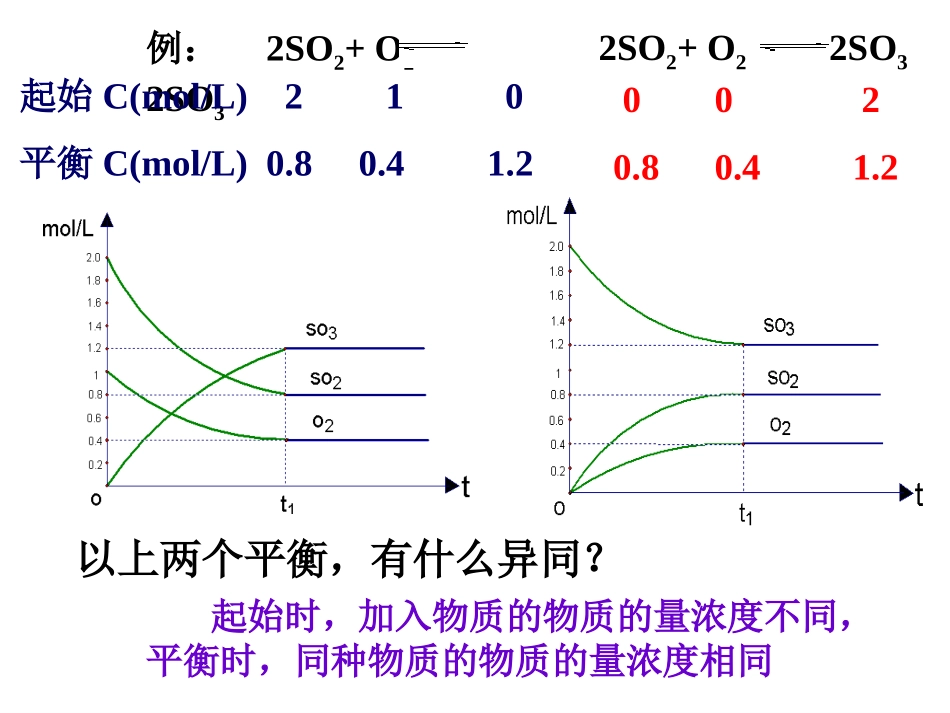
化学平衡状态1、概念:化学平衡状态是指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。2、特征:逆:研究对象为可逆反应等:V正=V逆判断反应是否处于平衡状态的因素动:V正=V逆≠0动态平衡定:各组分的浓度或其百分含量为定值变:条件变化,化学平衡状态亦发生变化例:2SO2+O22SO3起始C(mol/L)210平衡C(mol/L)0.80.41.22SO2+O22SO30020.80.41.2以上两个平衡,有什么异同?起始时,加入物质的物质的量浓度不同,平衡时,同种物质的物质的量浓度相同等效平衡:对有气体参加或生成的可逆反应,在一定条件下(恒温恒容或恒温恒压),对同一可逆反应,不论是从正反应开始还是从逆反应开始,只是起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的百分含量相同(体积分数、物质的量分数、或质量分数),这样的平衡称为等效平衡。等效平衡的判断方法任何状态的体系,都用“极端状态”来比较,只要能转化为相同的“极端状态”,就一定是等效平衡。途径1起始CO+H2OCO2+H22mol1mol00途径2起始途径3起始途径4起始4mol2mol001mol01mol1mol1.5mol0.5mol0.5mol0.5molT、V不变或T、P不变时:转化到一边物质的量完全相同或比例完全相同N2(g)+3H2(g)2NH3(g)T、V不变途径1起始途径2起始途径3起始1mol4mol001mol2mol0.5mol2.5mol1mol规律:转化到一边物质的量或浓度完全相同N2(g)+3H2(g)2NH3(g)T、P不变途径1起始途径2起始途径3起始1mol4mol00.5mol2mol00.5mol2.5mol1mol途径4起始1mol5mol2mol规律:转化到一边物质的量或浓度比例完全相同练习1、有一个固定体积的密闭容器中,加入2molA和1molB发生反应,2A(g)+B(g)3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达平衡时C的浓度仍为Wmol/L的是()A.4molA+2molBB.2molA+1molB+3molC+1molDC.3molC+1moD+1molBD.3molC+1molDE、1molA+0.5molB+1.5molC+0.5molDDEBC2、在一固定容积的密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)xC(g),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为()A、1B、2C、3D、43、在恒温、恒压的条件下,向可变容积的密闭容器中充入3LA和2LB,发生如下反应:3A(g)+2B(g)xC(g)+yD(g)达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则X,Y的值分别为()A、x=3y=1B、x=4y=1C、x=5y=1D、x=10y=2CD44、、在一个固定体积的密闭容器中,保持一定温度在一个固定体积的密闭容器中,保持一定温度进行以下反应:进行以下反应:HH22(g)(g)十十BrBr22(g)2HBr(g)(g)2HBr(g)已知已知加入加入lmolHlmolH22和和2molBr2molBr22时,达到平衡后生成时,达到平衡后生成amolHBramolHBr((见下表已知项见下表已知项))在相同条件下,且保持平衡时各组分在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号①一③的状态,填写表中的体积分数不变,对下列编号①一③的状态,填写表中的空白的空白2a00.52g-4m(g-m)a5、CO+H2OCO2+H2①、1mol1mol00②、1mol2mol00③、2mol1mol00④、2mol2mol00恒温恒容时,比较四种条件下CO转化率大小:②>①=④>③条件(T、V不变)反应物的平衡转化率加反应物再平衡后转化率比较m、a大小mama2NO2(g)ma2NH3N2+3H22HBr2HBrHH22十十BrBr22m=am
a6、填空N2O4(g)7、某温度下,向某密闭容器中加入1molN2和3molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若T不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m,若N2、H2、NH3的加入量用X、Y、Z表示应满足:(1)恒定T、V时:[1]若X=0,Y=0,则Z=。[2]若X=0.75,Y=,Z=。[3]X、Y、Z应满足的一般条件是(2)恒定T、P时:[1]若X=0、Y=0,则Z=[2]若X=0.75,则Y,Z。[3]X、Y、Z应满足的一般条件是2mol2.25mol0.5molX+Z/2=1Y+3Z/2=3>0=2.25mol≥0Y=3X,Z≥0条件等效条件结果恒温恒容(△n(g)≠0)恒温恒容(△n(g)=0)恒温恒压等效平衡小结投料换算成相同物质表示时物质的量相同两平衡各组分百分含量均相同(n、c相同)投料换算成相同物质表示时物质的量成比例两平衡各组分百分含量相同,(n、c按比例变化)投料换算成相同物质表示时物质的量成比例两平衡各组分百分含量相同,(c相同,n按比例变化)等效平衡时同种物质的百分含量相同