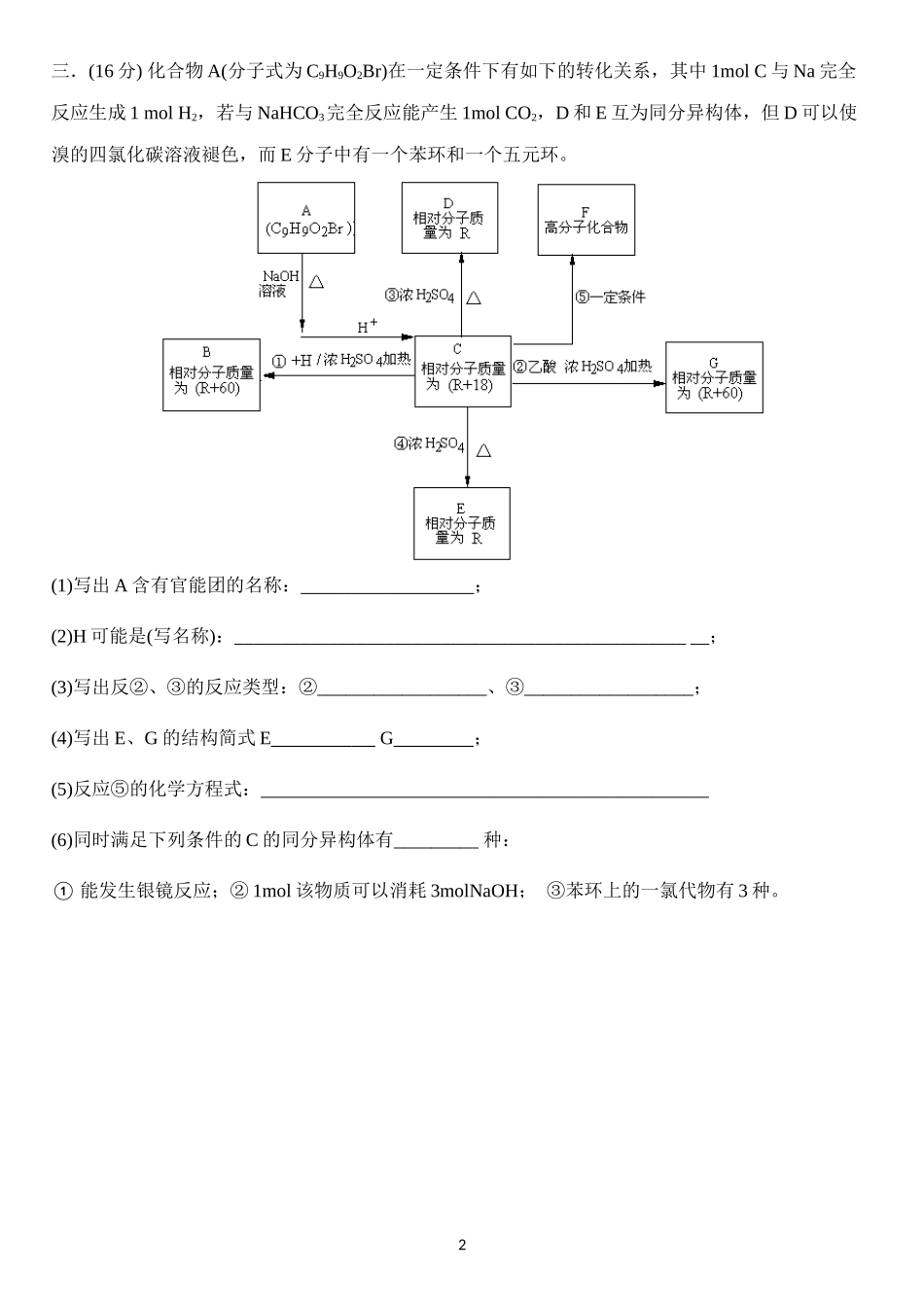
二卷综合训练一、硝酸是常见的三大强酸之一,在化学研究和化工生产中有着广泛应用,常用于制备硝酸盐、染料、肥料、医药中间体、烈性炸药等。硝酸盐多用于焰火、试剂、图像处理行业。1.某金属M的硝酸盐受热时按下式分解:2MNO32M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。由此可以计算出M的相对原子质量为_____________。2.将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体折算成标准状况下的体积为11.2L,其中NO的体积为_____________。3.现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(S.T.P.)。则产物中硝酸铜的物质的量为_____________。如果原混合物中有0.0lmolCu,则其中Cu2O与CuO的质量比为_____________。4.有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,HNO3被还原成NO,待反应结束后,标准状况下产生的气体____________升。5.加热某一硝酸铜的结晶水合物和硝酸银的混合物110.2g,使之完全分解,得到固体残渣48.4g。将反应后产生的气体通过水充分吸收后,剩余气体1.68L(S.T.P.),判断剩余气体是___________(填化学式);原混合物中硝酸铜结晶水合物的化学式为_______________。二、(一)电解饱和食盐水的阴极产物是(写化学式)。(二)废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。(1)回收二氯化锰。将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热,试写出MnO(OH)与浓盐酸反应的化学方程式:。(2)萃取法回收锰离子。实验室萃取操作中使用的玻璃仪器是。(3)制备锰锌铁氧体。锰锌铁氧体可用作隐形飞机吸收雷达波的涂料。一种以锌锰废电池为原料制备锰锌铁氧体的主要流程如下:①除汞时,铁粉的作用是_______(填“氧化剂”或“还原剂”或“吸附剂”)。在不同pH下,KMnO4溶液对Hg的吸收率的影响及主要产物如下图。②据图说明pH对Hg吸收率的影响规律③在强酸性环境下Hg的吸收率高的原因可能是。(4)锰回收新方法。向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为:2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O①每1molMnO2参加反应时,共有mol电子发生转移。②新方法的优点是(答1点即可)。1三.(16分)化合物A(分子式为C9H9O2Br)在一定条件下有如下的转化关系,其中1molC与Na完全反应生成1molH2,若与NaHCO3完全反应能产生1molCO2,D和E互为同分异构体,但D可以使溴的四氯化碳溶液褪色,而E分子中有一个苯环和一个五元环。(1)写出A含有官能团的名称:;(2)H可能是(写名称):__________________________________________________;(3)写出反②、③的反应类型:②__________________、③__________________;(4)写出E、G的结构简式EG;(5)反应⑤的化学方程式:(6)同时满足下列条件的C的同分异构体有_________种:①能发生银镜反应;②1mol该物质可以消耗3molNaOH;③苯环上的一氯代物有3种。2五、已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原予序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如右图。请回答:(1)A元素的名称是________________________;(2)B元素原子核外运动状态不同的电子数为__________,C元素原子价电子层的电子排布图为_______________,B与A形成的化合物比C与A形成的化合物沸点高,其原因是___________________________________________________________________________;(3)元素E在周期表中的位置是_______________,它的+2价离子的电子排布式为___________;(4)由以上五种元素的任意两种形成常见化合物中,所含离子键成分最多的可能为_______________________________(填写化学式);(5)如图所示,D跟B形成的离子化合物晶体的密...