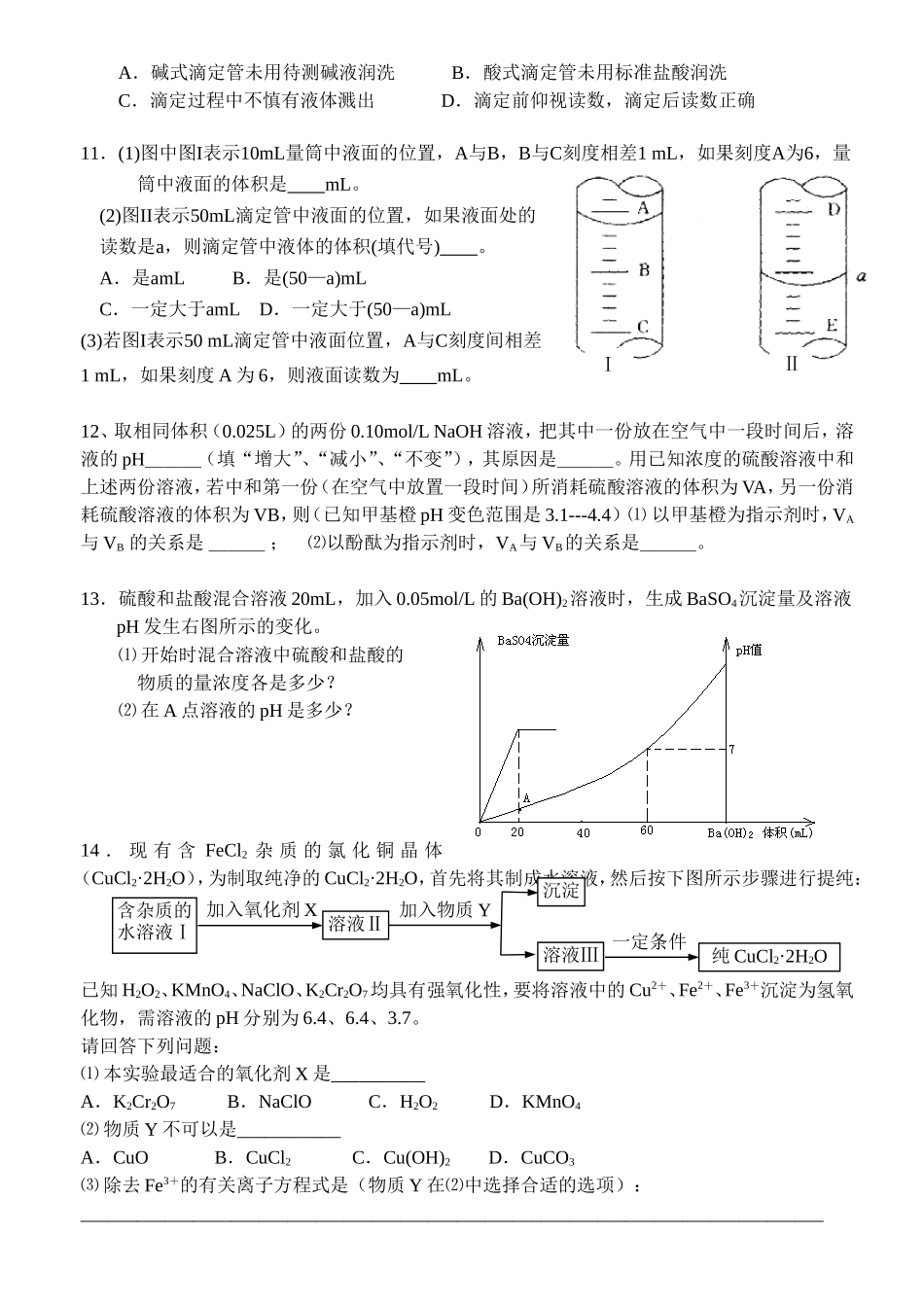
电解质溶液专项练习1.对某弱酸稀溶液加水稀释,下列叙述不正确的是()A.弱酸的电离程度增大B.溶液的导电性减弱C.弱酸分子的浓度减小D.溶液中的c(OH-)减小2.在—50℃,2NH3(液)NH4++NH2—,NH4+的平衡浓度为1.0X10—15mol/L,下列说法正确的是()①在液氨中加入NaNH2可使液氨的离子积变大②在液氨中加入NH4Cl可使液氨的离子积变小③此温度下液氨的离子积为1X10—30④在液氨中放入金属钠,有NaNH2生成。A.①③④B.②③C.①④D.③④3.25℃,某物质的溶液中由水电离出的c(H+)=1×10-amol·L-1下列说法不正确是()A.a>7时,该物质可能为强碱B.a<7时,水的电离受到抑制C.a<7时,该物质可能为强酸D.a>7时,水的电离受到抑制4.在0.100mol·L-1H2S溶液中,下列关系式中正确的是()A.c(HS-)>c(S2-)>c(H+)B.c(H+)>c(HS-)>c(S2-)C.c(H+)=c(HS-)+c(S2-)+c(OH-)D.c(H+)=c(HS-)+2c(S2-)+c(OH-)5.把0.02mol/LHAc溶液和0.01mol/LNaOH溶液以等体积混和后溶液呈酸性,则混合液中微粒浓度关系正确的为()A.c(Ac-)>c(Na+)B.c(HAc)>c(Ac-)C.2c(H+)=c(Ac-)-c(HAc)D.c(HAc)+c(Ac-)=0.01mol/L6.室温下,VaLpH=a的强酸与VbLpH=b的强碱溶液混合,混合后溶液pH=3。已知a+b=13,Vb=4.5Va,则a值为A.2B.3C.4D.57.20℃,两种一元弱酸的钠盐NaX和NaY,已知往NaX溶液中通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3,下列说法正确的是A.酸性HX>HYB.结合H+的能力Y->CO32->X->HCO3-C.溶液的碱性NaX>Na2CO3>NaY>NaHCO3D.HX和HY酸性相同,但比H2CO3弱8.常温下,某一元强酸HA和一元弱碱BOH的pH之和为14,有关这两种溶液混合的说法中不正确的是()A.混合之前两种溶液中由水电离产生的c(H+)相同B.若混合后恰好完全中和,反应液中水的电离程度比纯水中大C.若混合后溶液呈中性(pH=7),V(HA)>V(BOH)D.若等体积混合两种溶液,反应后因生成强酸弱碱盐而使溶液呈酸性9.在pH等于1的酸溶液与pH等于13的NaOH溶液中,分别加入过量的铝粉,若酸溶液放出的氢气多,其可能的原因是()A.两溶液体积相同,酸是多元强酸B.酸是强酸,且酸溶液的浓度是碱溶液浓度的3倍以上C.两溶液体积相同,酸是弱酸D.酸是强酸,且酸溶液的体积是碱溶液体积的3倍以上10.用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)()A.碱式滴定管未用待测碱液润洗B.酸式滴定管未用标准盐酸润洗C.滴定过程中不慎有液体溅出D.滴定前仰视读数,滴定后读数正确11.(1)图中图I表示10mL量筒中液面的位置,A与B,B与C刻度相差1mL,如果刻度A为6,量筒中液面的体积是mL。(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)。A.是amLB.是(50—a)mLC.一定大于amLD.一定大于(50—a)mL(3)若图I表示50mL滴定管中液面位置,A与C刻度间相差1mL,如果刻度A为6,则液面读数为mL。12、取相同体积(0.025L)的两份0.10mol/LNaOH溶液,把其中一份放在空气中一段时间后,溶液的pH___(填“增大”、“减小”、“不变”),其原因是___。用已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在空气中放置一段时间)所消耗硫酸溶液的体积为VA,另一份消耗硫酸溶液的体积为VB,则(已知甲基橙pH变色范围是3.1---4.4)⑴以甲基橙为指示剂时,VA与VB的关系是___;⑵以酚酞为指示剂时,VA与VB的关系是___。13.硫酸和盐酸混合溶液20mL,加入0.05mol/L的Ba(OH)2溶液时,生成BaSO4沉淀量及溶液pH发生右图所示的变化。⑴开始时混合溶液中硫酸和盐酸的物质的量浓度各是多少?⑵在A点溶液的pH是多少?14.现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。请回答下列问题:⑴本实验最适合的氧化剂X是__________A...