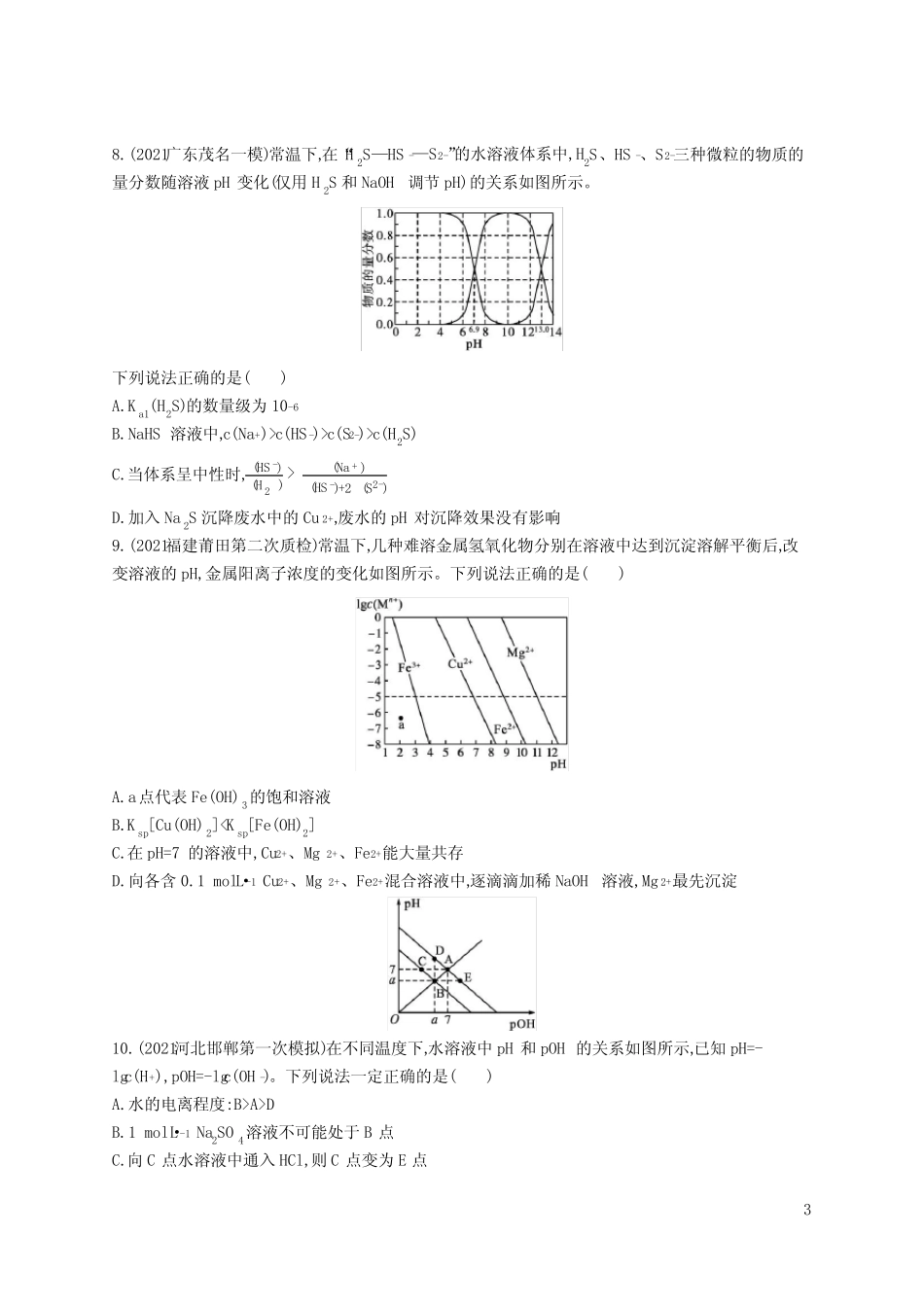
1水溶液中的离子反应与平衡一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。1.(2021江苏连云港老六所四星学校联考)下列有关表述正确的是()A.HClO是弱酸,所以NaClO是弱电解质B.向溶有氨气的CaCl2溶液中通SO2能看到白色沉淀C.室温下,AgCl在水中的溶解度小于在食盐水中的溶解度D.Na2O、Na2O2组成元素相同,所以与CO2反应产物也相同2.常温下,下列有关电解质溶液的说法错误的是()A.相同浓度的HCOONa和NaF两溶液,前者的pH较大,则Ka(HCOOH)>Ka(HF)B.相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,则溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则Ksp(FeS)>Ksp(CuS)D.在1mol·L-1Na2S溶液中,c(S2-)+c(HS-)+c(H2S)=1mol·L-13.(2021广西柳州模拟)25℃时,用浓度为0.1000mol·L-1的NaOH溶液滴定体积均是20mL、浓度均为0.1000mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是()A.酸性强弱顺序是HX>HY>HZB.加入10mLNaOH溶液时,HY溶液中c(Na+)>c(Y-)C.pH=2的HZ溶液加水稀释10倍,pH为3D.加入20mLNaOH溶液时,只有HY溶液达到滴定终点4.(2021四川内江第三次模拟)在两个锥形瓶中分别加入浓度均为1mol·L-1的盐酸和NH4Cl溶液,将温度和pH传感器与溶液相连,往瓶中同时加入过量的质量、形状均相同的镁条,实验结果如下图。关于该实验的下列说法,正确的是()A.P点溶液:c(NH4+)+2c(Mg2+)>c(Cl-)2B.反应剧烈程度:NH4Cl>HClC.Q点溶液显碱性是因为MgCl2发生水解D.1000s后,镁与NH4Cl溶液反应停止5.(2021山东泰安二模)T℃时,在20.00mL0.10mol·L-1CH3COOH溶液中滴入0.10mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。下列说法正确的是()A.T℃时,CH3COOH的电离平衡常数Ka=1.0×10-3B.M点对应的NaOH溶液的体积为20.00mLC.N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)D.N点与Q点所示溶液中水的电离程度:N>Q6.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是()A.混合溶液的导电能力与离子浓度和种类有关B.Na+与A2-的导电能力之和大于HA-的C.b点的混合溶液pH=7D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)7.(2021广东茂名二模)某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下,PbCO3和PbI2在不同的溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc(CO32-)或-lgc(I-)的关系如图所示。下列说法错误的是()A.Ksp(PbCO3)的数量级为10-14B.相同条件下,水的电离程度p点大于q点C.L1对应的是-lgc(Pb2+)与-lgc(I-)的关系变化D.p点溶液中加入Na2CO3浓溶液,可得白色沉淀38.(2021广东茂名一模)常温下,在“H2S—HS-—S2-”的水溶液体系中,H2S、HS-、S2-三种微粒的物质的量分数随溶液pH变化(仅用H2S和NaOH调节pH)的关系如图所示。下列说法正确的是()A.Ka1(H2S)的数量级为10-6B.NaHS溶液中,c(Na+)>c(HS-)>c(S2-)>c(H2S)C.当体系呈中性时,ᵅ(HS-)ᵅ(H2ᵄ)>ᵅ(Na+)ᵅ(HS-)+2ᵅ(S2-)D.加入Na2S沉降废水中的Cu2+,废水的pH对沉降效果没有影响9.(2021福建莆田第二次质检)常温下,几种难溶金属氢氧化物分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图所示。下列说法正确的是()A.a点代表Fe(OH)3的饱和溶液B.Ksp[Cu(OH)2]A>DB.1mol·L-1Na2SO4溶液不可能处于B点C.向C点水溶液中通入HCl,则C点变为E点4D.0.1mol·L-1NaHA溶液的pH和pOH的关系如图中E点所示,此时溶液中离子的物质的量浓度关系:c(HA-)>c(A2-)>c(H2A)二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。11.(2021北京顺义区一模)对Na2C2O4溶液进行研究,下列说...