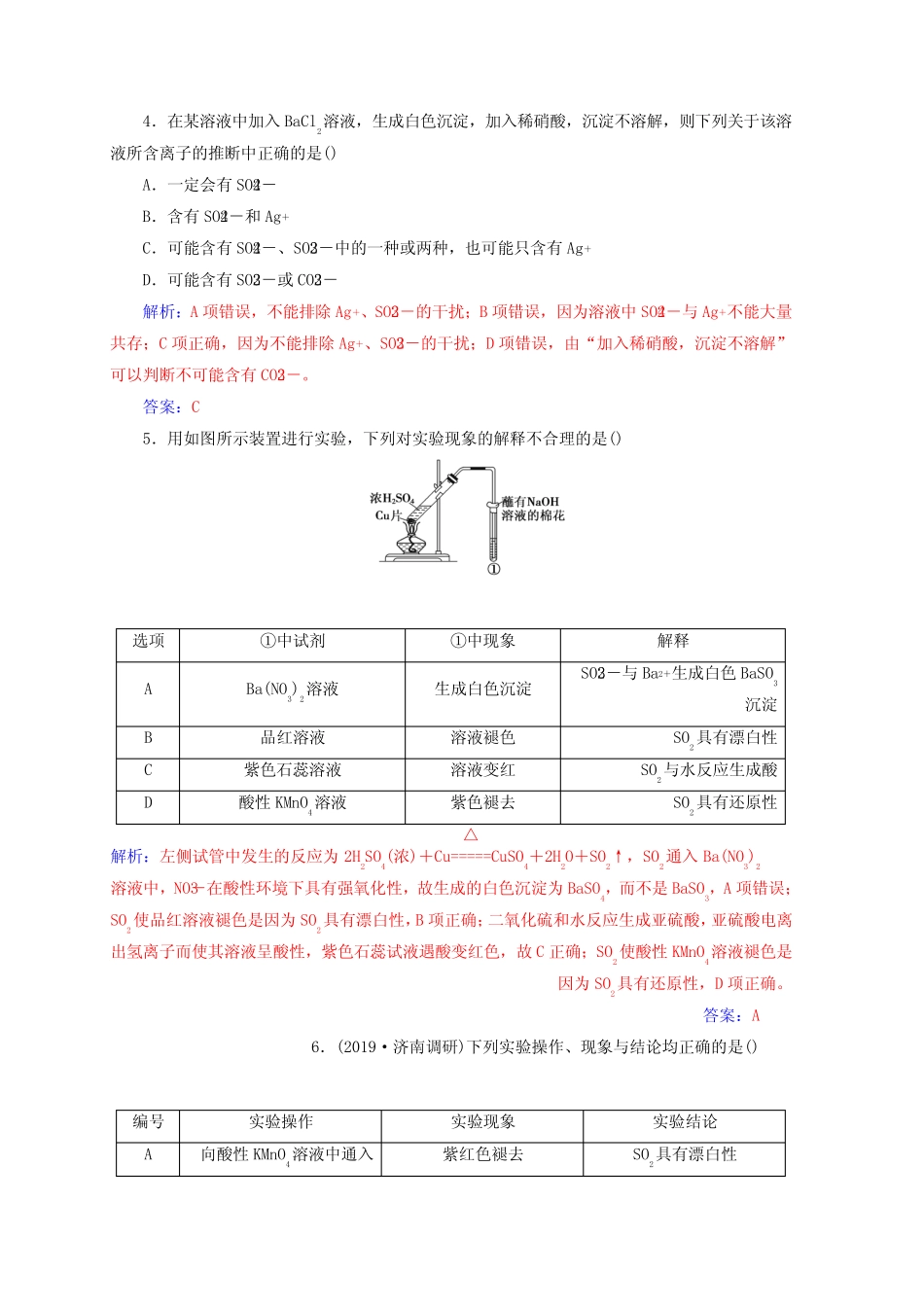
硫及其重要化合物1.据我国古代第一部药物学专著《神农本草经》记载:“石硫黄(即硫磺)能化金银钢铁,奇物”,所得产物不可能是()A.Au2SB.Ag2SC.CuSD.FeS解析:S单质的氧化性比较弱,所以只能将金属氧化为低价,所以将Au、Ag、Fe氧化为+1、+1、+2,转化为Au2S、Ag2S、FeS,所以选项A、B、D有可能;S氧化Cu应该转化为低价的Cu2S,选项C是不可能的。答案:C2.如图有关硫元素循环的说法不合理的是()A.煤、石油中的硫元素燃烧时能生成SO2B.动物尸体腐败过程产生的H2S气体会进入大气C.循环过程中硫元素既发生氧化反应又发生还原反应D.大气中的硫元素会全部转化成H2SO4随雨水降到土壤里解析:D项,大气中的硫元素部分转化成H2SO3随雨水降到土壤里,错误。答案:D3.SO2通入下列溶液中,溶液褪色或变浅,说明SO2具有漂白作用的组合是()①酸性KMnO4溶液②溴水③碘水④氯水⑤FeCl3溶液A.①⑤B.②③C.全部D.都不是解析:SO2能使酸性高锰酸钾溶液褪色,是由于酸性高锰酸钾溶液将SO2氧化为H2SO4,自身被还原成无色的Mn2+:2KMnO4+5SO2+2H2O===K2SO4+2MnSO4+2H2SO4。SO2能使卤水褪色,是由于X2(不包括F2)将SO2氧化为H2SO4,本身被还原为无色X-:SO2+X2+2H2O===H2SO4+2HX。SO2能使棕黄色的Fe3+变浅,是由于Fe3+氧化SO2生成H2SO4,本身被还原为浅绿色的Fe2+:SO2+2H2O+2Fe3+===2Fe2++4H++SO2-4。故以上均不是SO2的漂白作用。答案:D4.在某溶液中加入BaCl2溶液,生成白色沉淀,加入稀硝酸,沉淀不溶解,则下列关于该溶液所含离子的推断中正确的是()A.一定会有SO2-4B.含有SO2-4和Ag+C.可能含有SO2-4、SO2-3中的一种或两种,也可能只含有Ag+D.可能含有SO2-3或CO2-3解析:A项错误,不能排除Ag+、SO2-3的干扰;B项错误,因为溶液中SO2-4与Ag+不能大量共存;C项正确,因为不能排除Ag+、SO2-3的干扰;D项错误,由“加入稀硝酸,沉淀不溶解”可以判断不可能含有CO2-3。答案:C5.用如图所示装置进行实验,下列对实验现象的解释不合理的是()选项①中试剂①中现象解释ABa(NO3)2溶液生成白色沉淀SO2-3与Ba2+生成白色BaSO3沉淀B品红溶液溶液褪色SO2具有漂白性C紫色石蕊溶液溶液变红SO2与水反应生成酸D酸性KMnO4溶液紫色褪去SO2具有还原性解析:左侧试管中发生的反应为2H2SO4(浓)+Cu=====△CuSO4+2H2O+SO2↑,SO2通入Ba(NO3)2溶液中,NO-3在酸性环境下具有强氧化性,故生成的白色沉淀为BaSO4,而不是BaSO3,A项错误;SO2使品红溶液褪色是因为SO2具有漂白性,B项正确;二氧化硫和水反应生成亚硫酸,亚硫酸电离出氢离子而使其溶液呈酸性,紫色石蕊试液遇酸变红色,故C正确;SO2使酸性KMnO4溶液褪色是因为SO2具有还原性,D项正确。答案:A6.(2019·济南调研)下列实验操作、现象与结论均正确的是()编号实验操作实验现象实验结论A向酸性KMnO4溶液中通入紫红色褪去SO2具有漂白性SO2B向CuSO4溶液中通入H2S出现黑色沉淀酸性:H2S>H2SO4C向碘水溶液中加入CCl4,振荡上层褪色,下层变紫色碘在CCl4中的溶解度大于它在水中的溶解度D向装有蔗糖的烧杯中加入浓H2SO4出现“黑面包”现象浓H2SO4具有吸水性解析:向酸性KMnO4溶液中通入SO2,紫红色褪去,体现SO2的还原性,故A错误;酸性:H2SB>CD.加氧化亚铁可以使溶液C转化为溶液A解析:Fe2(SO4)3与SO2反应的离子方程式为2Fe3++SO2+2H2O===2Fe2++SO2-4+4H+,反应生成H+,故溶液酸性B>A,C项错误;溶液B中可能含有剩余的Fe3+,A项正确;B项离子方程式电荷不守恒,B项错误;溶液C为硫酸铁和硫酸溶液,FeO与H2SO4反应生成FeSO4,D项错误。答案:A8.为探究Na2SO3溶液的性质,在白色点滴板的a、b、c...