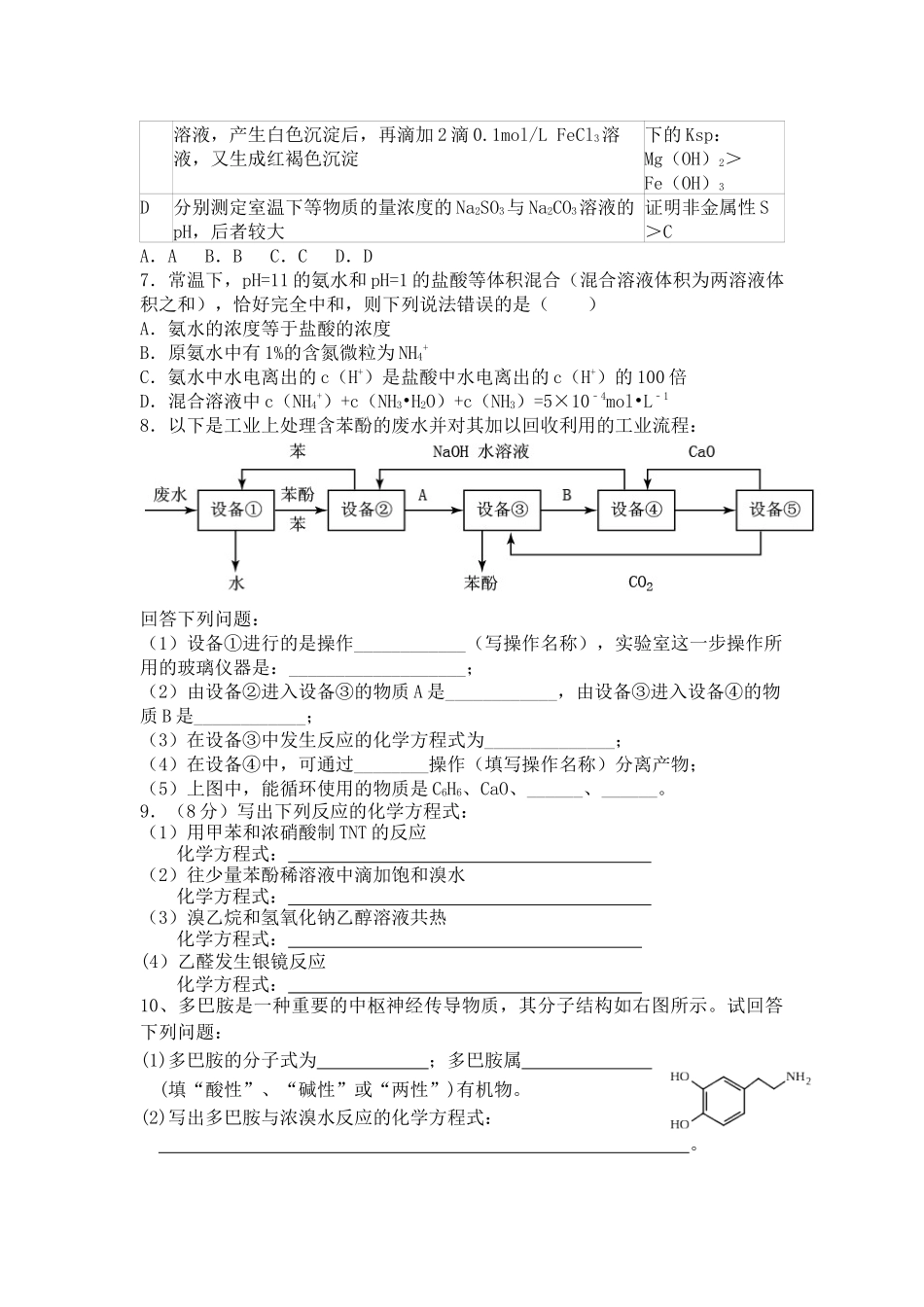
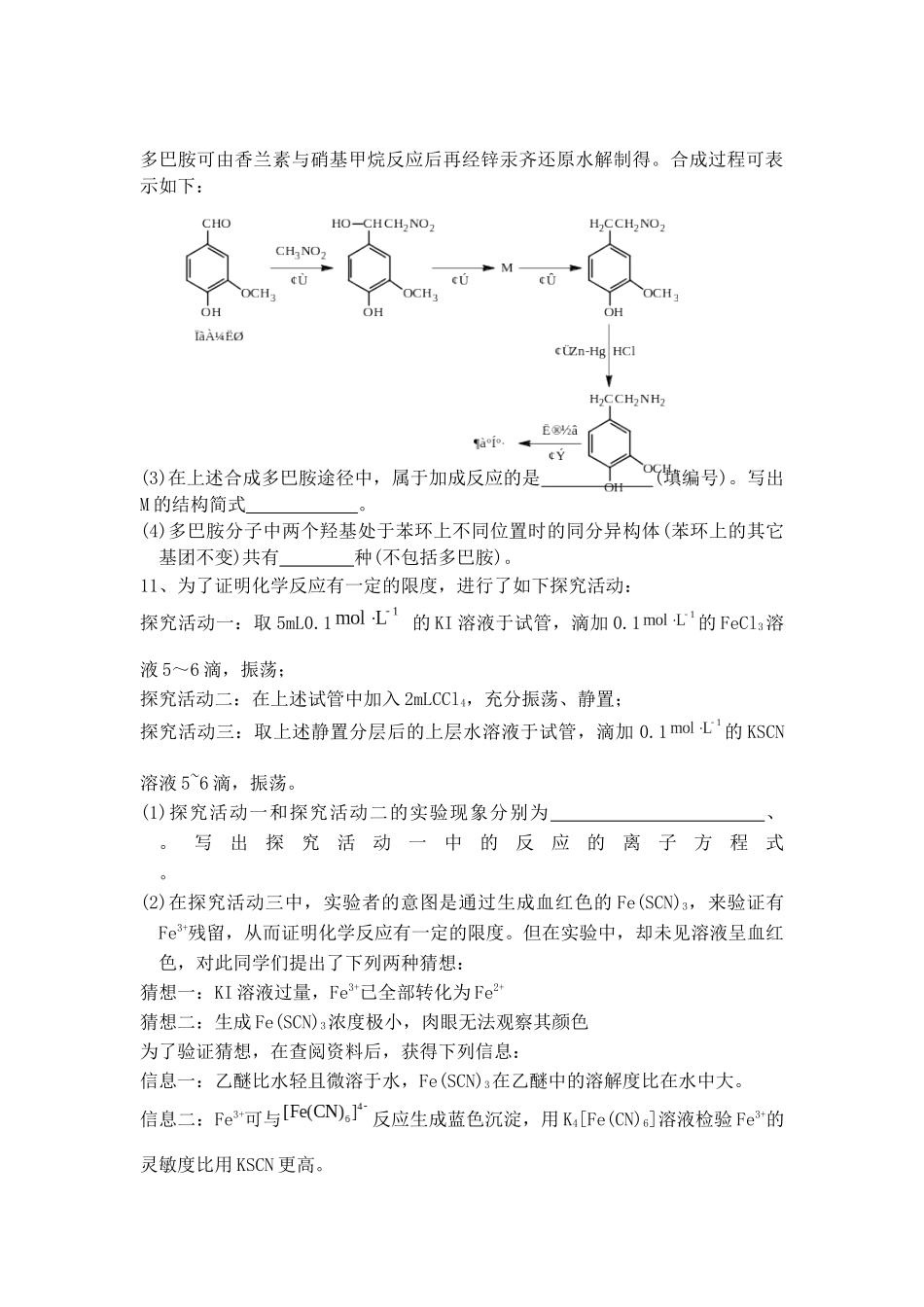
平定中学高三化学临门一脚模拟考试一、选择题(共7小题)1.化学与科学、技术、环境、生活密切相关.下列说法正确的是()A.CO2、CH4、N2等均是造成温室效应的气体B.“地沟油”经过加工处理后,可以用来制造燃油C.铁粉、生石灰、硅胶是食品包装中常用的干燥剂D.目前加碘食盐主要添加的是KI2.设NA表示阿伏伽德罗常数的值,下列说法正确的是(相对原子质量:H﹣1,N﹣14)()A.标准状况下,22.4LHCl溶于水后溶液中含有NA个HCl分子B.常温常压下,33.6LCl2中含有1.5NA个Cl2分子C.1.8g的NH4+离子中含有NA个电子D.将0.1mol氯化铝溶于1L水中,所得溶液含有0.1NAAl3+3.短周期元素X、Y、Z、W在元素周期表中的相对应位置如图所示,其中Z为地壳中含量最高的金属元素.下列说法正确的是()XYZWA.工业上电解YW饱和溶液冶炼金属YB.Y、W的最高价氧化物的水化物均能溶解金属ZC.气态氢化物的稳定性:W>XD.简单离子半径的大小顺序:r(Y+)>r(X﹣)4.下列陈述正确并且有因果关系的是()选项陈述Ⅰ陈述ⅡASO2有漂白性SO2可使溴水褪色BSiO2有导电性SiO2可用于制备光导纤维CFe3+有强氧化性FeCl3溶液可用于回收废旧电路板中的铜D浓硫酸有强氧化性浓硫酸可用于干燥H2和COA.AB.BC.CD.D5.50℃时,下列各溶液中,离子的物质的量浓度关系正确的是()A.饱和食盐水中:c(Na+)+c(H+)=c(Cl﹣)+c(OH﹣)B.饱和小苏打溶液中:c(Na+)=c(HCO3﹣)C.pH=4的醋酸中:c(H+)=4.0mol•L﹣1D.pH=12的纯碱溶液中:c(OH﹣)=1.0×10﹣2mol•L﹣16.下列实验能达到预期目的是()编号实验内容实验目的A室温下,用pH试纸分别测定浓度为0.1mol•L﹣1NaClO溶液和0.1mol•L﹣1CH3COONa溶液的pH比较HClO和CH3COOH的酸性强弱B向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅证明Na2CO3溶液中存在水解平衡C向10mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2证明在相同温度溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀下的Ksp:Mg(OH)2>Fe(OH)3D分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大证明非金属性S>CA.AB.BC.CD.D7.常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全中和,则下列说法错误的是()A.氨水的浓度等于盐酸的浓度B.原氨水中有1%的含氮微粒为NH4+C.氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍D.混合溶液中c(NH4+)+c(NH3•H2O)+c(NH3)=5×10﹣4mol•L﹣18.以下是工业上处理含苯酚的废水并对其加以回收利用的工业流程:回答下列问题:(1)设备①进行的是操作____________(写操作名称),实验室这一步操作所用的玻璃仪器是:___________________;(2)由设备②进入设备③的物质A是____________,由设备③进入设备④的物质B是____________;(3)在设备③中发生反应的化学方程式为______________;(4)在设备④中,可通过________操作(填写操作名称)分离产物;(5)上图中,能循环使用的物质是C6H6、CaO、______、______。9.(8分)写出下列反应的化学方程式:(1)用甲苯和浓硝酸制TNT的反应化学方程式:(2)往少量苯酚稀溶液中滴加饱和溴水化学方程式:(3)溴乙烷和氢氧化钠乙醇溶液共热化学方程式:(4)乙醛发生银镜反应化学方程式:10、多巴胺是一种重要的中枢神经传导物质,其分子结构如右图所示。试回答下列问题:(1)多巴胺的分子式为;多巴胺属(填“酸性”、“碱性”或“两性”)有机物。(2)写出多巴胺与浓溴水反应的化学方程式:。多巴胺可由香兰素与硝基甲烷反应后再经锌汞齐还原水解制得。合成过程可表示如下:(3)在上述合成多巴胺途径中,属于加成反应的是(填编号)。写出M的结构简式。(4)多巴胺分子中两个羟基处于苯环上不同位置时的同分异构体(苯环上的其它基团不变)共有种(不包括多巴胺)。11、为了证明化学反应有一定的限度,进行了如下探究活动:探究活动一:取5mL0.1的KI溶液于试管,滴加0.1的FeCl3溶液5~6滴,振荡;探究活动二:在上述试管中加入2mLCCl4,充分振荡、静置;探究活动三:取上述静置分层后的上层水溶液于试...